
【题目】A、B均为短周期元素中的一种,已知A的原子序数为n,A2+离子比B2-离子少8个电子,则B的原子序数为
A. n+4B. n+6C. n+8D. n+10
 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】2015年初,雾霾天气多次肆虐我国中东部地区,其中汽车尾气是造成空气污染的主要原因,汽车尾气净化的主要原理为:
2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图1所示.
2CO2(g)+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图1所示.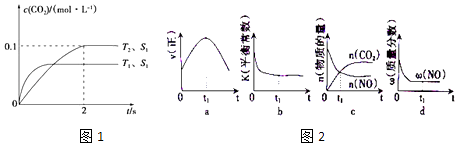
(1)该反应的△H0(选填“>”、“<”).
(2)在T2温度下,0~2s内的平均反应速率v(N2)= .
(3)当固体催化剂的质量一定时,增大其表面即可提高化学反应速率,若催化剂的表面积S1>S2 , 在图1中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线.
(4)若该反应在绝热、恒容的密闭体系中进行,图2的示意图正确且能说明反应在t1时刻处于化学平衡状态的是(填代号).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组甲设计了以下装置和方法测定空气中SO2含量.你认为可行的操作是
序号 | A | B | C |
装置 |
|
|
|
原理 | 通入V升空气,测定生成沉淀的质量 | 当KMnO4溶液刚好褪色时,测定通入空气的体积V | 通入V升空气,测定U型管增加的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al-Ag2O电池是一种可用作水下动力的优良电源,其原理如图所示。该电池工作时总反应式为2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O,则下列说法错误的是 ( )
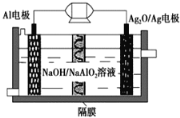
A. 工作时正极发生还原反应,且正极质量逐渐减小
B. 当电极上生成1.08 g Ag时,电路中转移的电子为0.01 mol
C. Al电极做负极,电极反应式为:Al-3e-=Al3+
D. 工作时电解液中的Na+移向Ag2O/Ag电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从能量的变化和反应的快慢等角度研究化学反应具有重要意义。
(1)已知一定条件下,反应N2+3H2![]() 2NH3为放热反应;:
2NH3为放热反应;:
①下图能正确表示该反应中能量变化的是________;
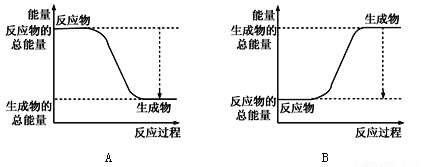
②根据下表数据,计算生成1molNH3时该反应放出的热量为______kJ;
化学键 | H-H | N≡N | N-H |
断开1mol键所吸收的能量 | 436kJ | 946kJ | 391kJ |
③一定温度下,将3molH2和1molN2通入容积为2 L的密闭容器中发生反应。若5min达到平衡,测得c(NH3)=0.4mol/L,则0至5min内N2的平均化学反应速率v(N2)=______,反应开始与平衡时气体的物质的量之比为__________;若达到平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0 ,请用p0、p来表示达到平衡时H2的转化率为__________。
④ 在③反应条件下,能够判断该反应已经达到化学平衡状态的是______________。
A.容器内混合气体密度不变
B.混合气体的压强不变
C.单位时间内生成n mol N2 的同时生成2n mol NH3
D. v (N2)=2v(NH3)
(2)原电池可将化学能转化为电能。由A、B、C、D四种金属按下表中装置进行实验:

①装置甲中SO![]() 向________ 极移动(填“A”或“B”);
向________ 极移动(填“A”或“B”);
②四种金属活动性由强到弱的顺序是_____________;
③若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后,取出洗净、干燥、称量,两电极质量差为6g,则导线中通过电子的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1ml 1.00mol/LHCl溶液和V2ml未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50ml),下列叙述正确的是( )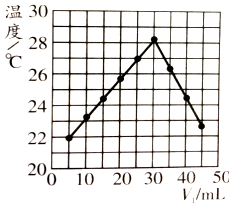
A.实验操作时的环境温度为22℃
B.实验表明热能可转化为化学能
C.该实验表明有水生成的反应都是放热反应
D.NaOH溶液的浓度约为1.50 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下反应4A(s)+3B(g)![]() 2C(g)+D(g)经2minB的浓度减少0.6mol·L-1,对此反应速率的表示正确的是( )
2C(g)+D(g)经2minB的浓度减少0.6mol·L-1,对此反应速率的表示正确的是( )
A. 用A表示的反应速率是0.4mol·L-1·min-1
B. 分别用B、C、D表示反应的速率,其比值是1∶2∶3
C. 2min末的反应速率v(B)=0.3mol·L-1·min-1
D. 在这2min任意一段时间内用B和C表示的正反应速率的值随时间变化都是逐渐减小的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com