在下列几种简单的原电池中,按要求填空:
(1)将锌、铜用导线连接后共同浸入2mol/L的稀硫酸中,正极电极反应式为______,发生______反应(填氧化或还原);电子从______经外电路到______(填锌或铜),溶液中H
+向______移动(填正极或负极),放电一段时间后,正极区pH值______(填变大、变小或不变).
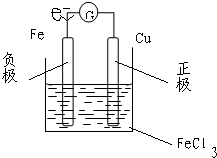
(2)将铜片和铁片用导线连接后插入三氯化铁溶液中,也有电流通过电流表.画出该电池结构的示意图,在图上标出正、负极,电解质和电子流向
写出负极电极反应式为______,
总反应的离子方程式为______.
(3)将铁片和石墨电极用导线连接后插入氯化钠溶液中,也有电流通过电流表,请写出负极电极反应式______,正极电极反应式为______.




 计算高手系列答案
计算高手系列答案