
| N |
| NA |
| V |
| Vm |
| m |
| M |
| 25.5g |
| 17g/mol |
| m |
| M(SO2) |
| m |
| M(SO3) |
| M(SO3) |
| M(SO2) |
| 80g/mol |
| 64g/mol |
| m |
| M(SO2) |
| m |
| M(SO3) |
| 2 |
| 64 |
| 3 |
| 80 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、将把1毫升饱和三氯化铁溶液逐滴加入20毫升沸水中(边加边振荡)并继续加热至沸,即可得到氢氧化铁胶体 |
| B、加热蒸干、灼烧后都有氧化铁生成 |
| C、二者都呈红褐色,可利用丁达尔效应鉴别 |
| D、将H2SO4溶液逐滴加入Fe(OH)3胶体内,开始时产生沉淀,继续滴加时沉淀又溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
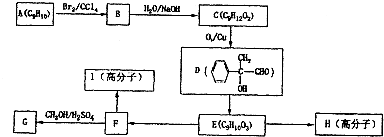
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、SiO32-、Cl-、NO3- |
| B、H+、NH4+、Al3+、SO42- |
| C、Na+、S2-、OH-、SO42- |
| D、Na+、CO32-、CH3COO-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X2气过量 |
| B、X2气Y2气各50mL |
| C、产物是双原子分子 |
| D、无法作出上述判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、拉瓦锡阐明了质量守恒定律 |
| B、道尔顿创立分子学说 |
| C、门捷列夫发现了元素周期律 |
| D、勒沙特列发现化学平衡移动原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 序号 | 碳酸钙 状态 | C(HCl)/ mol?L-1 | 溶液温度/℃ | 碳酸钙消失 时间/s | |
| 反应前 | 反应后 | ||||
| 1 | 块状 | 0.5 | 20 | 39 | 400 |
| 2 | 粉末 | 0.5 | 20 | 40 | 60 |
| 3 | 块状 | 0.6 | 20 | 41 | 280 |
| 4 | 粉末 | 0.8 | 20 | 40 | 30 |
| 5 | 块状 | 1.0 | 20 | 40 | 120 |
| 6 | 块状 | 1.0 | 30 | 50 | 40 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com