
| A、滴加酚酞试液显红色的溶液:Fe2+、NH4+、Cl-、I- |
| B、水电离出来的C (H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ |
| C、在C (H+)=10-13mol/L的溶液:K+、SO42-、Al3+、Cl- |
| D、PH=1的溶液:Cu2+、Na+、Mg2+、NO3- |


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
| A、由于碘在酒精中的溶解度大,所以可用酒精把碘水中的碘萃取出来 |
| B、水的沸点为100℃,酒精的沸点为78.5℃,所以可用加热蒸馏方法,使含水的酒精变为无水酒精 |
| C、四氯化碳和水混合后,可用分液的方法来分离 |
| D、NaCl溶解度随温度下降而减小,所以用冷却法从热的含少量KNO3的NaCl溶液中分离得到纯净的NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4种 | B、5种 | C、6种 | D、7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲苯中混有少量的苯酚可用加入浓溴水过滤除去 |
| B、实验室制硝基苯:在试管中加入1.5mL浓硝酸后逐滴加入2mL浓硫酸混合均匀,冷却到50℃以下,在不断振荡下,逐滴加入1mL苯,并注意避免使混合物的温度超过60℃.塞上带导管的橡皮塞,50℃~60℃水浴加热 |
| C、CH4中含有少量C2H4可通入足量酸性KMnO4溶液除去 |
| D、已烷和水、溴苯和水、二溴乙烷和水都能用分液漏斗分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫化钠的水解反应:S2-+H3O+?HS-+H2O |
| B、碳酸钠的水解:CO32-+2H2O?H2CO3+2OH- |
| C、向Ba(OH)2溶液滴KHSO4溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| D、Na2HPO4溶于水后发生电离:Na2HPO4=2Na++HPO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、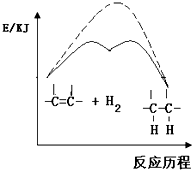 说明烯烃与H2的加成反应是放热反应,虚线表示在有催化剂的条件下表示 |
B、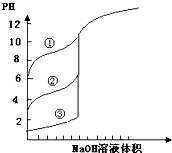 用0.1000mol/L NaOH溶液分别滴定浓度相同的三种一元酸,曲线可确定①的酸性最强 |
C、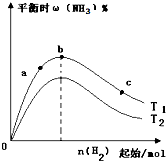 表示合成氨反应在其他条件不变的情况下,改变起始n(H2)对平衡的影响.由此可知,N2转化率最高的是b点;且T1>T2,K2>K1(T1和T2 表示温度,K1、K2表示对应温度下的平衡常数) |
D、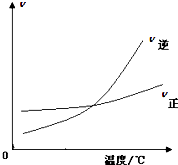 表示可逆反应“A2(g)+3B2 (g)?2AB3(g)”△H小于0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
| N2 | H2 | NH3 | |
| 甲 | 1 | 3 | 0 |
| 乙 | 0.5 | 1.5 | 1 |
| 丙 | 0 | 0 | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com