
【题目】下列有关问题,与盐的水解有关的是( )
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂③草木灰与铵态氮肥不能混合施用④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞⑤加热蒸干AlCl3溶液得到Al2O3固体
A. ①②③ B. ②③④⑤ C. ②③④ D. ①②③④⑤
【答案】D
【解析】
①铵根离子和锌离子水解显酸性;
②碳酸氢根离子与铝离子发生双水解生成二氧化碳;
③铵根离子水解呈酸性,碳酸根离子水解显碱性;
④碳酸根、硅酸根离子水解显碱性和玻璃中的二氧化硅反应;
⑤加热蒸干AlCl3溶液:AlCl3溶液中存在水解平衡:AlCl3+3H2O![]() Al(OH)3+3HCl
Al(OH)3+3HCl
①铵根离子和锌离子水解显酸性,和铁锈反应,除去铁锈,故①有关;
②碳酸氢根离子与铝离子发生双水解生成二氧化碳,用于灭火,故②有关;
③草木灰的主要成分为碳酸钾,水解显碱性,铵态氮肥水解显酸性,不能混合施用,故③有关;
④碳酸钠溶液水解显碱性,而磨口玻璃塞中的二氧化硅会与碱反应生成硅酸钠,将瓶塞与瓶口粘合在一块儿而打不开,因此实验室盛放碳酸钠的试剂瓶应用橡胶塞,故④有关;
⑤AlCl3溶液中存在水解平衡:AlCl3+3H2O![]() Al(OH)3+3HCl,加热时,HCl挥发使平衡不断右移,Al(OH)3分解,最终得到Al2O3固体,故⑤有关;
Al(OH)3+3HCl,加热时,HCl挥发使平衡不断右移,Al(OH)3分解,最终得到Al2O3固体,故⑤有关;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下图所示为某种胃药的核心合成反应部分过程:
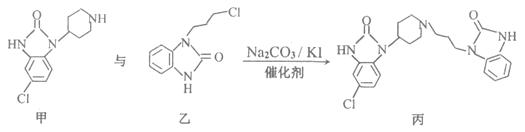
下列说法正确的是( )
A.甲中的两个![]() 键的活性相同B.乙所有原子在同一平面上
键的活性相同B.乙所有原子在同一平面上
C.丙的分子式![]() D.该反应生成丙的原子利用率小于100%
D.该反应生成丙的原子利用率小于100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如右图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:Z>W>X
C. 四种元素的单质中,Z单质的熔、沸点最低
D. W的单质能与水反应,生成一种具有漂白性的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g) + H2(g) ΔH1已知:②C4H10(g) +![]() O2(g)= C4H8(g) + H2O(g) ΔH2=-119 kJ·mol-1③H2(g) +
O2(g)= C4H8(g) + H2O(g) ΔH2=-119 kJ·mol-1③H2(g) + ![]() O2(g)= H2O(g) ΔH3=-242kJ·mol-1.反应①的ΔH1为_____ kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x_______0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是_____(填标号)。
O2(g)= H2O(g) ΔH3=-242kJ·mol-1.反应①的ΔH1为_____ kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x_______0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是_____(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强

(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是______________________。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。590 ℃之后,丁烯产率快速降低的主要原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无论在办公室还是居室里,在漂亮的花瓶中插上一束美丽的鲜花,将会给紧张而又忙碌的工作、生活带来轻松和愉悦的心情。如果在花瓶中加入“鲜花保鲜剂”,就会延长鲜花的寿命。下表是1 L“鲜花保鲜剂”的成分,阅读后回答下列问题:

(1)“鲜花保鲜剂”中物质的量浓度最大的成分是________(填写名称)。
(2)“鲜花保鲜剂”中K+的物质的量浓度为(阿司匹林不含K+)________mol·L-1(只要求写表达式,不需计算)。
(3)配制过程中,下列操作对配制结果没有影响的是________(填字母)。
A.容量瓶在使用前未干燥,里面有少量蒸馏水
B.定容时仰视液面
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(4)欲确定“鲜花保鲜剂”中硝酸银的浓度,则加入的试剂中应含有________(填化学符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 已知2H2(g)+O2(g)=2H2O(g) ΔH=-480.4kJ/mol ,则H2的燃烧热为ΔH=-240.2kJ/mol
B. 已知N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92.0kJ/mol,则将1molN2(g))和3molH2(g)置于一密闭容器中充分反应后放出的热量小于92.0kJ
2NH3(g)ΔH=-92.0kJ/mol,则将1molN2(g))和3molH2(g)置于一密闭容器中充分反应后放出的热量小于92.0kJ
C. 已知甲烷氧化:CH4(g)+O2(g)=CO2(g) +2H2(g)ΔH=-322.0kJ/mol,则反应物的键能总和大于生成物的键能总和
D. 测量中和热的实验时,应选用的试剂为50ml 0.5mol/L的盐酸与50ml 0.5mol/L的NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是

A.O点溶液中所含溶质的化学式为NaOH、Na2CO3
B.a点溶液中c (HCO3-) > c (CO32-)
C.标准状况下,通入CO2的体积为44.8L
D.原NaOH溶液的物质的量浓度为5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质A-F是我们熟悉的单质或化合物,其中A、B均是常见的金属,且B的合金用量最大;E在常温下是黄绿色气体;适当的条件下,它们之间可以发生如图所示的转化。

(1)G溶液中溶质的化学式为_____________。
(2)请写出反应D→F的化学方程式:_________。
(3)检验F中金属阳离子的常用试剂是______________(填物质的化学式);现象是____________。
(4)E物质可与石灰乳反应制取漂白粉,写出漂白粉的有效成分_________。
(5)写出C与过量氢氧化钠溶液反应的离子方程式_______________。
(6)若向D溶液中滴加氢氧化钠溶液,现象是:____,反应过程中的化学方程式为:____,______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式 (i)I2(g)+H2(g)![]() 2HI(g) △H=" -" 9.48kJ/mol ,(ii) I2(s)+H2(g)
2HI(g) △H=" -" 9.48kJ/mol ,(ii) I2(s)+H2(g)![]() 2HI(g) △H=" +" 26.48kJ/mol,下列判断正确的是
2HI(g) △H=" +" 26.48kJ/mol,下列判断正确的是
A. 254g I2(g)中通入2g H2(g),反应放热9.48 kJ
B. 1 mol固态碘与1mol气态碘所含的能量相差l7.00 kJ
C. 反应(i)的产物比反应(ii)的产物稳定
D. 反应(i) 拆开1mol I-I键与1mol H-H键需要的总能量小于拆开2mol H-I键需要的总能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com