
【题目】兴趣小组在实验室中模拟利用甲烷和氯气发生取代反应制取副产品盐酸,设计如图装置,下列说法错误的是
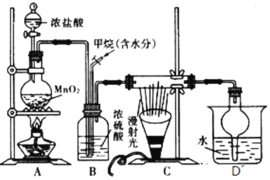
A.实验时先点燃A处酒精灯再通甲烷
B.从D中分离出盐酸的方法为过滤
C.装置C经过一段时间的光照射后,生成的有机物有4种
D.装置B有均匀混合气体、控制气流速度、干燥混合气体等作用
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】从物质A(某正盐)的水溶液出发有下面所示的一系列变化:

(1)写出A~F物质的化学式:
A__________;B__________;C__________;D__________;E.__________;F__________。
(2)写出E→F的化学方程式______________________________。
(3)鉴别物质F中阴离子的方法是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
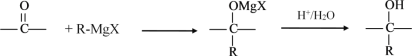
【题目】格氏试剂在有机合成方面用途广泛,可用卤代烃和镁在醚类溶剂中反应制得。
设R为烃基,已知RX +Mg![]() R-MgX(格氏试剂)
R-MgX(格氏试剂)
阅读以下合成路线图,回答有关问题:

(1)反应I的类型是____________,反应II的条件是____________。
(2)反应III的化学方程式为____________。
(3)E的同分异构体中,含有苯环且能发生银镜反应的有机物共有____________种。
(4)有机物![]() 是合成药物中的一种原料,实验室可用下列合成路线合成该有机物:
是合成药物中的一种原料,实验室可用下列合成路线合成该有机物:
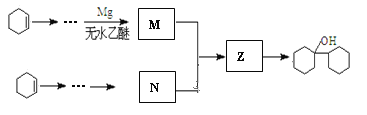
其中Z的结构简式为____________,用反应流程图表示以环己烯(![]() )为有机原料合成有机物N。____________
)为有机原料合成有机物N。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学对实验室乙酸乙酯的制取和分离进行了实验探究。
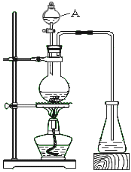
(制备)下列是该小组同学设计的实验装置。回答下列问题:
(1)仪器A的名称____________。
(2)装置中长导管的主要作用除导气外,还有一个作用是____________。
(分离)锥形瓶中得到的产物是乙酸乙酯、乙酸、乙醇的混合物,为了分离该混合物,设计了如下流程:
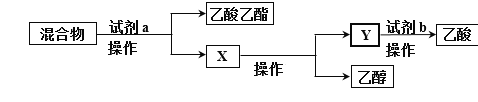
(3)试剂a是_______,试剂b是_______;操作Ⅰ是_______,操作Ⅱ是_______。(填写序号)
①稀硫酸 ②饱和Na2CO3溶液 ③蒸馏 ④分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是

A.每生成2分子AB吸收bkJ热量
B.断裂1molA-A键和1molB-B键,放出akJ能量
C.该反应中反应物的总能量高于产物的总能量
D.该反应热为(a-b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol·L-1HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
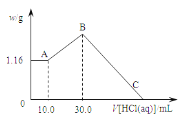
试回答:
(1)A点沉淀的化学式为______。
(2)写出A点至B点发生反应的离子方程式_______。
(3)求原混合物中AlCl3的质量____和NaOH的物质的量____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4超干重整CO2技术可得到富含CO的化工原料。回答下列问题:
(1)CH4超干重整CO2的催化转化如图所示:

①关于上述过程Ⅱ的说法不正确的是________(填序号)。
a.实现了含碳物质与含氢物质的分离
b.可表示为CO2+H2=H2O(g)+CO
c.CO未参与反应
d.Fe3O4、CaO为催化剂,降低了反应的ΔH
②其他条件不变,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应CH4(g)+CO2(g)=2CO(g)+2H2(g)进行相同时间后,CH4的转化率随反应温度的变化如图所示。a点所代表的状态_________(填“是”或“不是”)平衡状态;b点CH4的转化率高于c点,原因是_________________________________________。
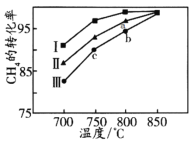
(2)在一刚性密闭容器中,加入Ni/α-Al2O3催化剂并加热至1123K,使CH4和CO2发生反应CH4(g)+CO2(g)=2CO(g)+2H2(g),初始时CH4和CO2的分压分别为20kPa、25kPa,研究表明CO的生成速率υ(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,某时刻测得p(CO)=20kPa,则p(CO2)=________kPa,υ(CO)=________mol·g-1·s-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.2 mol·L-1的HX溶液中c(HX):c(X-)=99:1,下列说法正确的是
A.升温至 30℃时,溶液 c(HX):c(X)=99:1B.25℃时K(HX)≈2×l0-5
C.向溶液中加入适量NaX溶液,酸的电离平衡向左移动,新平衡时c(X-)减小D.加水稀释后,溶液中c(X-)、c(H+)、c(OH-)均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是白色粉末,微溶于水,酸性条件下不稳定,易生成金属 Cu 和Cu2+,广泛应用于化工和印染等行业。某研究性学习小组拟热分解 CuC122H2O 制备 CuCl,并进行相关探究。下列说法不正确的是( )
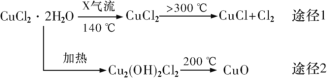
A.途径 1 中产生的Cl2 可以回收循环利用
B.途径 2 中 200℃时反应的化学方程式为:Cu2(OH)2Cl2![]() 2CuO+2HCl↑
2CuO+2HCl↑
C.X 气体是HCl,目的是抑制 CuCl22H2O 加热过程可能的水解
D.CuCl 与稀硫酸反应的离子方程式为:2CuCl+4H++SO42—=2Cu2++2Cl—+SO2↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com