
(12分)(1)下列原子的外围电子排布式(或外围轨道表示式)中,那一种状态的能量较低?并指出处于能量较低状态时原子中的未成对电子数

(2)31号元素镓(Ga)是半导体材料之一。
①写出镓原子的电子排布式,指出镓元素在元素周期表中的位置。
②写出镓元素的最高价氧化物、氯化物的化学式。
(1)①B 3个 ②A 1 ③A 6个 (共6分)
(2)①1S2 2S2 2P6 3S2 3P6 3d10 4S2 4P1 (2分)
第四周期ⅢA族 (2分)
②Ga2O3 GaCl3 (2分)
【解析】(1)①因为轨道中的电子处于全充满或半充满是稳定的,B稳定,其中未成对电子数3个,答案选B。
②3s的轨道的能量低于3p的,能量越低越稳定,A正确,其中未成对电子数是1个,答案选A。
③因为轨道中的电子处于全充满或半充满是稳定的,A正确,其中未成对电子数是6个,答案选A。
(2)①根据构造原理可知,镓原子的电子排布式为1S2 2S2 2P6 3S2 3P6 3d10 4S2 4P1,所以镓元素在元素周期表中的位置第四周期ⅢA族。
②第ⅢA元素的最高价是+3价,所以最高价氧化物、氯化物的化学式分别是Ga2O3、GaCl3。


科目:高中化学 来源:2011-2012学年安徽省六安三中高一下学期期末考试化学B卷(带解析) 题型:问答题
(12分)(1)下列原子的外围电子排布式(或外围轨道表示式)中,那一种状态的能量较低?并指出处于能量较低状态时原子中的未成对电子数
(2)31号元素镓(Ga)是半导体材料之一。
①写出镓原子的电子排布式,指出镓元素在元素周期表中的位置。
②写出镓元素的最高价氧化物、氯化物的化学式。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年安徽省六安三中高一下学期期末考试化学B卷(带解析) 题型:实验题
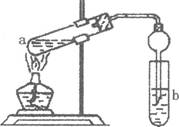
(12分)(1)下列实验操作或对实验事实的叙述正确的是__(填序号)
| A.用托盘天平称取4.00g干燥的NaOH固体,溶解于6ml蒸馏水中,配制10%NaOH溶液;配制氢氧化铜悬浊液,在一定量硫酸铜溶液中,加入少量10%氢氧化钠溶液。 |
| B.实验室蒸馏石油时,在蒸馏烧瓶中加入一些碎瓷片,防止暴沸;冷凝管下口进冷水,上口出热水。 |
| C.钠是活泼金属,易和空气中氧气、水反应,实验室将钠保存在无水酒精中。 |
| D.煤是由无机物和有机物组成的复杂混合物,其中含有苯、甲苯、二甲苯等有机物,可以用干馏方法获得苯。 |
查看答案和解析>>
科目:高中化学 来源:2014届安徽省高一下学期期末考试化学B卷(解析版) 题型:实验题
(12分)(1)下列实验操作或对实验事实的叙述正确的是__(填序号)
A.用托盘天平称取4.00g干燥的NaOH固体,溶解于6ml蒸馏水中,配制10%NaOH溶液;配制氢氧化铜悬浊液,在一定量硫酸铜溶液中,加入少量10%氢氧化钠溶液。
B.实验室蒸馏石油时,在蒸馏烧瓶中加入一些碎瓷片,防止暴沸;冷凝管下口进冷水, 上口出热水。
C.钠是活泼金属,易和空气中氧气、水反应,实验室将钠保存在无水酒精中。
D.煤是由无机物和有机物组成的复杂混合物,其中含有苯、甲苯、二甲苯等有机物,可以用干馏方法获得苯。
E.多数有机反应很慢,往往需要加热,采用水浴加热易控制温度且受热均匀,石油分馏、苯和浓硝酸发生取代反应、银镜反应、油脂水解均必需水浴加热。
F.用渗析法分离淀粉中混有的NaN03杂质,用盐析方法提纯蛋白质。
(2)如右图,在试管a中先加入2mL95%的乙醇,边摇动边缓缓加入5mL浓H2S04并充分摇匀,冷却后再加入2g无水醋酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入 7mL饱和碳酸钠溶液。连接好装置。用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验。
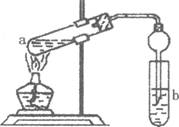
①加人浓H2S04的作用是______________________________________
②试管b中观察到的主要现象是_________________________________
③在实验中球形干燥管除起冷凝作用外,另一个重要作用是___________________________
④饱和Na2C03溶液的作用是__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分) (1)下列曲线分别表示元素某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质),把与下面的元素有关性质相符合的曲线的标号填入相应括号中。
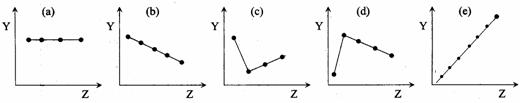 |
① ⅡA族元素的最外层电子数( ) ② ⅦA族元素氢化物的沸点( )
③ O2-、F-、Na+、Mg2+、Al3+的离子半径( ) ④第三周期元素的最高化合价( )
⑤ 第二周期元素Be、B、C、N、O的原子半径( )
(2) 比较下列性质(用“>”、“=”、“<”填空)
① 氧化性 Cl2 Br2 ② 酸性 H3PO4 H2SO4 ③ 碱性 Mg(OH)2 Al(OH)3
④ 稳定性 H2S H2O ⑤ 还原性H2S HCl
(3) 元素性质呈周期性变化的决定因素是 。
A.元素原子半径大小呈周期性变化 B.元素的相对原子质量依次递增
C.元素原子核外电子排布呈周期性变化 D.元素的最高正化合价呈周期性变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com