
| A. | 氯化铁溶液 饱和溴水 | B. | 碳酸钠溶液 饱和溴水 | ||
| C. | 酸性高锰酸钾溶液 饱和溴水 | D. | 酸性高锰酸钾溶液 氯化铁溶液 |
分析 己烯、甲苯、乙酸乙酯、苯酚溶液,先加溴水,溴水褪色的为己烯,生成白色沉淀的为苯酚;现象相同的甲苯、乙酸乙酯,然后另取两种液体少许,分别滴加高锰酸钾,褪色的为甲苯,出现分层的为乙酸乙酯,以此来解答.
解答 解:氯化铁只能检验出苯酚,己烯、苯酚均能使酸性高锰酸钾溶液褪色,不能鉴别;
则己烯、甲苯、乙酸乙酯、苯酚溶液,先加溴水,溴水褪色的为己烯,生成白色沉淀的为苯酚;现象相同的甲苯、乙酸乙酯,然后另取两种液体少许,分别滴加高锰酸钾,褪色的为甲苯,出现分层的为乙酸乙酯,
故选C.
点评 本题考查有机物的鉴别,为高频考点,侧重有机物性质及鉴别方法的考查,把握有机物的官能团与性质及反应的不同现象为鉴别的关键,题目难度不大.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量NaHCO3固体,v(H2)不变 | B. | 加入少量Na2SO4固体,v(H2)增大 | ||
| C. | 加入少量NaHSO4固体,v(H2)增大 | D. | 加入少量CuSO4溶液,v(H2)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)2C═O+HCN→(CH3)2C(OH)CN 属于加成反应 | |
| B. | CH3OH、CH2OHCH2OH、CH2OHCHOHCH2OH是同系物 | |
| C. |  属于取代反应 属于取代反应 | |
| D. | 1molCH3CH3与Cl2完全反应生成六氯乙烷时,消耗Cl26mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和H2O | B. | CCl4和KCl | C. | NaCl和HCl | D. | SO2和SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .分别写出②和⑦、③和⑧化合产物的电子式
.分别写出②和⑦、③和⑧化合产物的电子式 、
、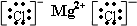 .⑤和⑥的气态氢化物的稳定性NH3>CH4(写化学式).⑦和⑧的最高价氧化物的水化物的酸性HClO4>H2SO4(写化学式).
.⑤和⑥的气态氢化物的稳定性NH3>CH4(写化学式).⑦和⑧的最高价氧化物的水化物的酸性HClO4>H2SO4(写化学式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷 | B. | 乙烷和丙烷 | C. | 乙烷和甲烷 | D. | 戊烷和己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室配制银氨溶液时,应将2%硝酸银滴入2mL 2%的氨水中 | |
| B. | 除去乙酸乙酯中的部分乙醇和乙酸可用饱和Na2CO3溶液 | |
| C. | 卤代烃和酯的水解都可用浓硫酸作催化剂 | |
| D. | 在卤代烃水解后的溶液中加入硝酸银溶液观察沉淀现象就可确定其中的卤素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com