
【题目】下列说法中正确的是( )
A.干冰、液态氯化氢都是电解质
B.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
C. NaOH晶体中既含有离子键又含有共价键
D.Na2O、Fe2O3、Al2O3既属于碱性氧化物,又属于离子化合物
科目:高中化学 来源: 题型:
【题目】电子工业中,常用氯化铁溶液作为印刷电路铜板蚀刻液。请按要求回答下列问题:
(1)若向氯化铁溶液中加入一定量的澄清石灰水,调节溶液pH,可得红褐色沉淀,该反应的离子方程式为:______________________________________,该过程中调节溶液的pH为5,则c(Fe3+)为:____________mol·L-1。(己知:Ksp[Fe(OH)3]= 4.0×10-38)
(2)某探究小组设计如下线路处理废液和资源回收:
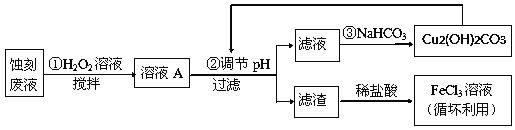
①用足量FeCl3溶液蚀刻铜板后的废液中含有的金属阳离子有:_______________。
②FeCl3蚀刻液中通常加入一定量的盐酸,其中加入盐酸的目的是:_________________。
③步骤①中加入H2O2溶液的目的是:______________________________________。
④已知:生成氢氧化物沉淀的pH
Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 4.7 | 7.0 | 1.9 |
沉淀完全时 | 6.7 | 9.0 | 3.2 |
根据表中数据推测调节pH的范围是:________________。
⑤写出步骤②中生成CO2的离子方程式:__________(已知Cu2(OH)2CO3难溶于水)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】七水硫酸镁(MgSO47H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣﹣硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 | ||||||
pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 | ||||||
表2 两种盐的溶解度(单位为g/100g水)
温度/℃ | 10 | 30 | 40 | 50 | 60 | ||||||||||||
CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 | ||||||||||||
MgSO47H2O | 30.9 | 35.5 | 40.8 | 45.6 | / | ||||||||||||
硼镁泥制取七水硫酸镁的工艺流程如下:
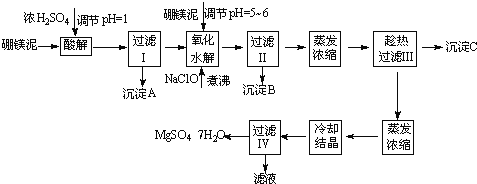
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为 .加热煮沸的主要目的是 。
(2)沉淀B中除MnO2、SiO2外还含有 (填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是 。
(4)沉淀C的化学式是 .过滤Ⅲ需趁热过滤的理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | |||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | 温度℃ | |
① | 0.10 | 2.0 | 0.010 | 4.0 | 20 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 20 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 40 |
(1)写出该反应的化学方程式 。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是____________。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=_____________mol·L-1·min-1。
(4) 若保持其他条件不变,下图两条曲线分别表示20℃和40℃时c(MnO)~反应时间t的变化曲线。40℃时c(MnO)~t的变化曲线为 。(填写A或B)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33 ℃、沸点为114 ℃。请按要求回答下列相关问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为_______________。
(2)用于微电子器件生产的锡粉纯度测定:①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;②加入过量的Fe2(SO4)3;③用0.1000 mol/L K2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。步骤②中加入Fe2(SO4)3的作用是__________________;此锡粉样品中锡的质量分数_____________。
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
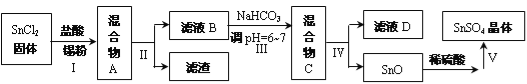
①步骤Ⅰ加入Sn粉的作用: __________________及调节溶液pH。
②步骤Ⅱ、步骤Ⅴ的操作名称为________________,写出该过程用到的一种玻璃仪器的名称:_______________。
③步骤Ⅲ生成SnO的离子方程式:__________________。
④步骤Ⅴ操作依次为 _____________、____________、过滤、洗涤、低温干燥。
(4)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的同位素![]() ,它的氯化物XCl21.11g溶于水配成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,求:
,它的氯化物XCl21.11g溶于水配成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,求:
(1)Z值和A值。
(2)X元素在周期表中的位置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将X气体通入BaCl2溶液,未见沉淀生成,然后通入Y气体,有沉淀生成,X、Y不可能是( )
A.SO2 、 H2S B.NH3、 CO2 C.Cl2 、 CO2 D.SO2 、Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】E是一种治疗心血管疾病的药物,它的合成路线如下:
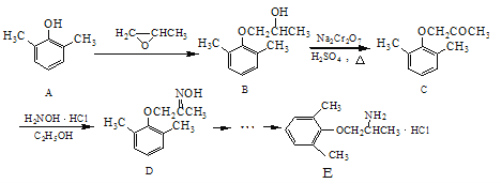
(1)C分子中含氧官能团的名称为_________________。
(2)由B→C的反应类型为_____________。
(3)由A制备B的过程中有少量副产物F,它与B互为同分异构体,E的结构简式为___________。
(4)写出同时满足下列条件的D的一种同分异构体的结构简式:___________。
①属于α-氨基酸;
②是苯的衍生物,且苯环上的一氯代物只有两种;
③分子中含有两个手性碳原子。
(5)已知乙烯在催化剂作用与氧气反应可以生成环氧乙烷(![]() )。写出以邻甲基苯酚 (
)。写出以邻甲基苯酚 ( 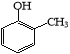 )和乙醇为原料制备
)和乙醇为原料制备 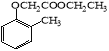 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:H2C=CH2
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com