
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | |||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | 温度℃ | |
① | 0.10 | 2.0 | 0.010 | 4.0 | 20 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 20 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 40 |
(1)写出该反应的化学方程式 。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是____________。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=_____________mol·L-1·min-1。
(4) 若保持其他条件不变,下图两条曲线分别表示20℃和40℃时c(MnO)~反应时间t的变化曲线。40℃时c(MnO)~t的变化曲线为 。(填写A或B)

【答案】(1) 2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O
(2)②和③ ①和② (3)0.025(或2.5×10-2) (4)A (最后一空1分,其余每空2分)
【解析】
试题分析:(1)根据反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,利用化合价升降相等写出反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑;
(2)探究温度对化学反应速率影响,必须满足除了温度不同,其他条件完全相同,所以满足此条件的实验编号是:②和③;探究反应物浓度对化学反应速率影响,除了浓度不同,其他条件完全相同的实验编号是①和②;
(3)草酸的物质的量为:0.10molL-1×0.002L=0.0002mol,高锰酸钾的物质的量为:0.010molL-1×0.004L=0.00004mol,草酸和高锰酸钾的物质的量之比为:0.0002mol:0.00004mol=5:1,显然草酸过量,高锰酸钾完全反应,混合后溶液中高锰酸钾的浓度为:(0.010mol/L×0.004L)÷(0.002L+0.004L)=![]() ×0.010mol/L,这段时间内平均反应速率v(KMnO4)=
×0.010mol/L,这段时间内平均反应速率v(KMnO4)=![]() ×0.010mol/L÷(40/60min)=0.010molL-1min-1,反应速率之比是相应的化学计量数之比,则这段时间内平均反应速率v(H2C2O4)=2.5×0.010molL-1min-1=0.025 mol·L-1·min-1。
×0.010mol/L÷(40/60min)=0.010molL-1min-1,反应速率之比是相应的化学计量数之比,则这段时间内平均反应速率v(H2C2O4)=2.5×0.010molL-1min-1=0.025 mol·L-1·min-1。
(4)25℃时反应速率小于40℃时,所以高锰酸根离子的浓度变化比40℃时小,反应需要的时间大于40℃条件下需要的时间,根据图像可判断40℃时c(MnO4-)~t的变化曲线为A。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】在含有FeBr2和FeI2的混合溶液中,通入过量的氯气,然后把溶液加热蒸干、灼烧,最后留下的是
①FeCl2②FeCl3③I2④Br2⑤Fe(OH)3⑥Fe2O3⑦FeO
A.①③④
B.③⑦
C.③⑤
D.⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | Y | Z | |
X | 硫 | W |
回答下列问题
(1)W元素在周期表中的位置为__________。
(2)表中元素原子半径最大的是(写元素符号)__________。
(3)写出由上表中两种元素组成,可用作制冷剂的一种化合物的电子式__________。
(4)下列事实不能说明Z元素的非金属性比S元素的非金属性强的是__________;
A.Z单质与H2S溶液反应,溶液变浑浊
B.在氧化还原反应中,1molY单质比1molS得电子多
C.Z和S两元素的简单氢化物受热分解,前者的分解温度高
(5)X与W两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法制取有广泛用途的Na2FeO4,同时获得氢气。工作原理如图1所示,c( Na2FeO4)随初始c(NaOH)的变化如图2。
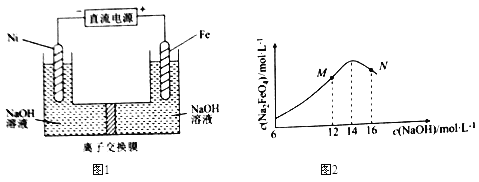
已知:FeO42-为紫红色;Na2FeO4只在强碱性条件下稳定,易被H2还原;溶液中OH-浓度过高,铁电极区会产生红褐色物质。下列说法错误的是( )
A.制备Na2FeO4的电极反应为Fe-6e-+8OH-=FeO42-+4H2O
B.电解过程中,须将阴极产生的气体及时排出
C.MN两点中c(Na2FeO4)低于最高值的原因不同,在M点会有Fe(OH)3生成
D.图1中的离子交换膜为阴离子交换膜,电解过程中,阴极区附近pH会增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把下列四种X溶液分别加入四个盛有10 mL 2 mol/L盐酸的烧杯中,均加水稀释到50 mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是( )
A.10 ℃ 20 mL 3 mol/L的X溶液
B.10 ℃ 10 mL 2 mol/L的X溶液
C.20 ℃ 10 mL 4 mol/L的X溶液
D.20 ℃ 30 mL 2 mol/L的X溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.干冰、液态氯化氢都是电解质
B.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
C. NaOH晶体中既含有离子键又含有共价键
D.Na2O、Fe2O3、Al2O3既属于碱性氧化物,又属于离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W为五种短周期元素。X原子的质子数与电子层数相同,W原子核外电子数是M原子最外层电子数的2倍,Y、Z、M、W在周期表中的相对位置如图所示。下列说法不正确的是
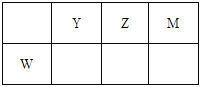
A. 原子半径:W>Y>Z>M>X
B. 热稳定性:XM>X2Z,沸点:X2Z>YX3
C. X、Y、Z三种元素形成的化合物中不可能含离子键
D. ZM2、YM3、WM4分子中每个原子最外层均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向甲乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B。相同条件下(温度T ℃),发生下列反应:A(g)+B(g) ![]() xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
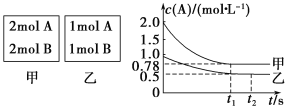
(1)乙容器中,平衡后物质A的转化率为________
(2)x=________
(3)T ℃时该反应的平衡常数为________
(4)下列说法中正确的是
A.向平衡后的乙容器中充入氦气可使重新达到平衡时的c(A)增大
B.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内相同
C.若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中A的浓度范围为0.78 mol·L-1<c(A)<1.56 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com