
【题目】X、Y、Z、M、W为五种短周期元素。X原子的质子数与电子层数相同,W原子核外电子数是M原子最外层电子数的2倍,Y、Z、M、W在周期表中的相对位置如图所示。下列说法不正确的是
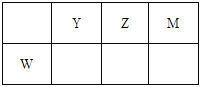
A. 原子半径:W>Y>Z>M>X
B. 热稳定性:XM>X2Z,沸点:X2Z>YX3
C. X、Y、Z三种元素形成的化合物中不可能含离子键
D. ZM2、YM3、WM4分子中每个原子最外层均满足8电子结构
【答案】C
【解析】试题分析:X、Y、Z、M、W为5种短周期元素,X的质子总数与电子层数相同,则X为H元素;Y、Z、M同周期且相邻,W原子核外电子数是M原子最外层电子数的2倍,则Z为O元素,可推知Y为N元素、M为F元素、W为Si,综上所述:X为氢、Y为氮、Z为氧、M为氟、W为硅;A.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径Si>N>O>F>H,故A正确;B.XM为HF,X2Z为H2O,元素的非金属性越强,其气态氢化物越稳定,由于非金属性F>O,故HF>H2O正确;水中含有氢键,O-H键长短与N-H,故沸点:H2O>NH3,故B正确;C.H、N、O三种元素形成的化合物可以是硝酸铵,硝酸铵中既有离子键又有共价键,故C错误;D.ZM2、YM3、WM4分别为OF2、NH3、SiF4,此三种物质每个原子最外层均满足8电子结构,故D正确,故选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知溶液中:还原性HSO3―>I―,氧化性IO3―>I2>>SO32―。向含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如下图所示,下列说法正确的是

A.a点反应的还原剂是NaHSO3,被氧化的元素是碘元素
B.b点反应的离子方程式是:3HSO3-+IO3-+3OH-=3SO42-+I-+3H2O
C.c点到d点的反应中共转移0.6mol电子
D.往200ml 1mol/LKIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式是:
5HSO3-+2IO3-=I2+5SO42-+3H++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | |||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | 温度℃ | |
① | 0.10 | 2.0 | 0.010 | 4.0 | 20 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 20 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 40 |
(1)写出该反应的化学方程式 。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是____________。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=_____________mol·L-1·min-1。
(4) 若保持其他条件不变,下图两条曲线分别表示20℃和40℃时c(MnO)~反应时间t的变化曲线。40℃时c(MnO)~t的变化曲线为 。(填写A或B)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的同位素![]() ,它的氯化物XCl21.11g溶于水配成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,求:
,它的氯化物XCl21.11g溶于水配成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,求:
(1)Z值和A值。
(2)X元素在周期表中的位置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将X气体通入BaCl2溶液,未见沉淀生成,然后通入Y气体,有沉淀生成,X、Y不可能是( )
A.SO2 、 H2S B.NH3、 CO2 C.Cl2 、 CO2 D.SO2 、Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Na2CO3、NaAlO2的混合溶液中逐滴加入1molL-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系如图所示,则下列说法正确的是( )

A.原混合溶液中的CO2-3与AlO-2的物质的量之比为1:2
B.V1:V2=1:5
C.M点时生成的CO2为0.05mol
D.a曲线表示的离子方程式为:AlO-2+H++H2O=Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】E是一种治疗心血管疾病的药物,它的合成路线如下:
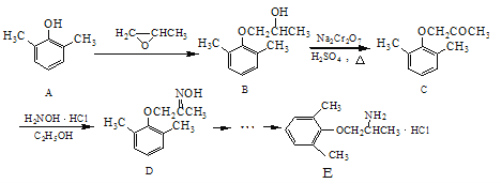
(1)C分子中含氧官能团的名称为_________________。
(2)由B→C的反应类型为_____________。
(3)由A制备B的过程中有少量副产物F,它与B互为同分异构体,E的结构简式为___________。
(4)写出同时满足下列条件的D的一种同分异构体的结构简式:___________。
①属于α-氨基酸;
②是苯的衍生物,且苯环上的一氯代物只有两种;
③分子中含有两个手性碳原子。
(5)已知乙烯在催化剂作用与氧气反应可以生成环氧乙烷(![]() )。写出以邻甲基苯酚 (
)。写出以邻甲基苯酚 ( 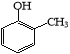 )和乙醇为原料制备
)和乙醇为原料制备 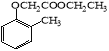 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:H2C=CH2
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铁是重要工业颜料,以废铁屑为原料制备氧化铁的步骤如下:(部分操作和条件略)
步骤1:用碳酸钠溶液洗去铁屑表面的油污。
步骤2:加入稍过量的稀硫酸,保持50~80℃,充分反应后,过滤。
步骤3:将滤液与稍过量的NH4HCO3溶液混合,得到FeCO3的浊液。
步骤4: 、 、干燥,得到FeCO3固体。
步骤5:煅烧FeCO3,得到Fe2O3固体。
(1)步骤2中,如何判断反应已经充分? 。
(2)步骤2所得的滤渣中主要含有一种铁的化合物W(Fe3C),经以下处理后,回收利用:W在足量的空气中高温煅烧,生成有磁性的固体X;将X溶于稀硫酸。
①煅烧时1 mol W消耗O2 mol。
②X溶于稀硫酸的离子方程式为 。
(3)步骤3生成FeCO3反应的化学方程式为 。
(4)将步骤4补充完整: 、 。
(5)若煅烧时条件控制不当,会使产品中存在杂质FeO。
①若要设计实验检验产品中是否存在FeO,且只能选用两种试剂,这两种试剂是 。
②现煅烧116.0 kg的FeCO3,得到79.2 kg产品,则该产品的纯度为__________。(设产品中只有一种杂质FeO,计算结果保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是
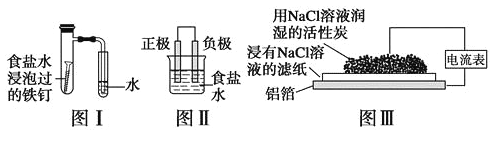
A.按图Ⅰ装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管
B.图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁
C.铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl--2e-=Cl2↑
D.图Ⅲ装置的总反应为4Al+3O2+6H2O=4Al(OH)3,生成的Al(OH)3进一步脱水形成白斑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com