
【题目】在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是
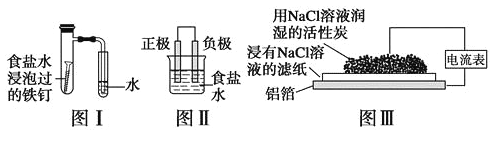
A.按图Ⅰ装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管
B.图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁
C.铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl--2e-=Cl2↑
D.图Ⅲ装置的总反应为4Al+3O2+6H2O=4Al(OH)3,生成的Al(OH)3进一步脱水形成白斑
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W为五种短周期元素。X原子的质子数与电子层数相同,W原子核外电子数是M原子最外层电子数的2倍,Y、Z、M、W在周期表中的相对位置如图所示。下列说法不正确的是
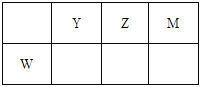
A. 原子半径:W>Y>Z>M>X
B. 热稳定性:XM>X2Z,沸点:X2Z>YX3
C. X、Y、Z三种元素形成的化合物中不可能含离子键
D. ZM2、YM3、WM4分子中每个原子最外层均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向甲乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B。相同条件下(温度T ℃),发生下列反应:A(g)+B(g) ![]() xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
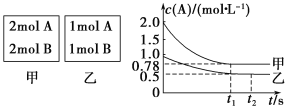
(1)乙容器中,平衡后物质A的转化率为________
(2)x=________
(3)T ℃时该反应的平衡常数为________
(4)下列说法中正确的是
A.向平衡后的乙容器中充入氦气可使重新达到平衡时的c(A)增大
B.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内相同
C.若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中A的浓度范围为0.78 mol·L-1<c(A)<1.56 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
I.已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
2Fe(s)+3/2O2(g)=Fe2O3(s) △H=-825.5 kJ/mol
则反应:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H= kJ/mol。
2Fe(s)+3CO2(g) △H= kJ/mol。
II.反应1/3Fe2O3(s)+CO(g)![]() 2/3Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡。
2/3Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡。
(1)CO的平衡转化率= _____________。
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
III.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+ 2H2(g)![]() CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:

(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=____________。
(2)若在一体积可变的密闭容器中充入l molCO、2molH2和1molCH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向____________(填“正”、“逆”)反应方向移动。
(3)以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
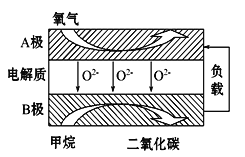
1)B极上的电极反应式为 。
2)若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,当阳极收集到11.2L(标准状况)气体时,消耗甲烷的体积为 L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是( )
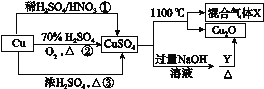
A.途径①所用的混酸中H2SO4与HNO3的物质的量之比最好为3∶2
B.相对于途径①、③,途径②更好地体现了绿色化学思想
C.1 mol CuSO4在1100 ℃所得混合气体X中O2一定为0.75 mol
D.Y可以是葡萄糖溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化亚铜是一种白色粉末,不溶于冷水,在热水中或见光都会分解,在空气中会慢慢氧化成绿色粉末。制备CuBr的实验步骤如下:
步骤1.在如图所示的三颈烧瓶中加入45gCuSO4·5H2O、19gNaBr、150mL煮沸过的蒸馏水,60℃时不断搅拌,以适当流速通入SO2 2小时。
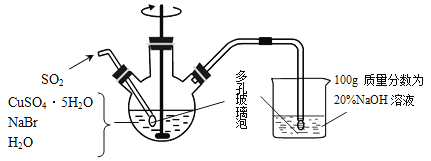
步骤2.溶液冷却后倾去上层清液,在避光的条件下过滤。
步骤3.依次用溶有少量SO2的水、溶有少量SO2的乙醇、纯乙醚洗涤。
步骤4.在双层干燥器(分别装有浓硫酸和氢氧化钠)中干燥3~4h,再经氢气流干燥,最后进行真空干燥。
(1)实验所用蒸馏水需经煮沸,煮沸目的是除去其中水中的 (写化学式)。
(2)步骤1中:①三颈烧瓶中反应生成CuBr的离子方程式为 ;
②控制反应在60℃进行,实验中可采取的措施是 ;
(3)步骤2过滤需要避光的原因是 。
(4)步骤3中洗涤剂需“溶有SO2”的原因是 ;最后溶剂改用乙醚的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃有两种或两种以上的同分异构体,其同分异构体中的某一种的一氯代物只有一种,则这种烃可能是:①分子具有7个碳原子的芳香烃②分子中具有4个碳原子的烷烃③分子中具有12个氢原子的烷烃④分子中具有8个碳原子的烷烃( )
A.①② B.②③ C.③④ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
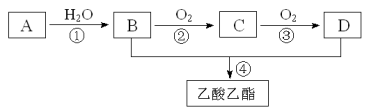
回答下列问题:
(1)写出A生成的高分子的结构简式 。
(2)B、D分子中的官能团名称分别是 、 。
(3)写出下列反应的反应类型: ① ② 。
(4)写出下列反应的化学方程式:
① ;
④ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
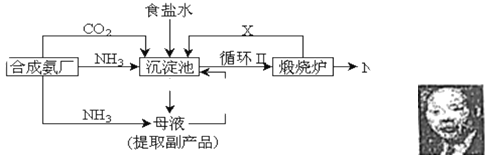
(1)上述生产纯碱的方法称 ,副产品的一种用途为 。
(2)沉淀池中发生的化学反应方程式是 。
(3)写出上述流程中X物质的分子式 。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是 。
(5)为了有效地除去粗盐中的Ca2+、Mg2+、SO42-,加入试剂的顺序为 (选填a、b、c)。
a.先加NaOH,后加Na2CO3,再加BaCl2
b.先加NaOH,后加BaCl2,再加Na2CO3
c.先加BaCl2,后加NaOH,再加Na2CO3
(6)为检验产品碳酸钠中是否含有氯化钠,其方法是 。
(7)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
A.增大NH4+的浓度,使NH4Cl更多地析出
B.使NaHCO3更多地析出
C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com