

| A.原子序数X<Y<W<Z | B.纯净的X与纯净的Z反应生成XZ3 |
| C.Z的最高正价为+6 | D.HW是热稳定性最强的氢化物 |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.离子半径:C3->D->B+>A2+ | B.原子序数:d>c>b>a |
| C.原子半径:A>B>D>C | D.原子的最外层电子数目:A>B>D>C |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题

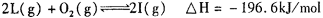 。向一个容积不变的 容器中,充入2mol L和1molO2,使之充分反应,放出的热量为Q,则Q_______196. 6kJ (填“ >”、“〈”或“=”)。
。向一个容积不变的 容器中,充入2mol L和1molO2,使之充分反应,放出的热量为Q,则Q_______196. 6kJ (填“ >”、“〈”或“=”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径:As>Cl>P | B.热稳定性:HCl>AsH3>HBr |
| C.还原性:As3->S2->Cl- | D.酸性:H3AsO4>H2SO4>H3PO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com