
| A. | N2→NH3 | B. | HCl→H2 | C. | NO→NO2 | D. | Fe2O3→Fe |
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:选择题
| A. | 充电时电池反应为FePO4+Li═LiFePO4 | |
| B. | 充电时动力电池上标注“+”的电极应与外接电源的负极相连 | |
| C. | 放电时电池内部Li+向正极移动 | |
| D. | 放电时,在正极上是Li+得电子被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
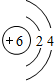 ;X元素基态原子的电子排布式为1s22s22p63s23p5.
;X元素基态原子的电子排布式为1s22s22p63s23p5.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S(g)+O2(g)=SO2(g)△H1,S(s)+O2(g)=SO2(g)△H2;△H1>△H2 | |
| B. | C(石墨,s)=C(金刚石,s)△H=+1.9kJ/mol,则可判定金刚石比石墨稳定 | |
| C. | 中和热的实验过程中,环形玻璃搅拌棒材料若用铜代替,则测出的中和热数值偏小 | |
| D. | 已知反应:①101kPa时,2C(s)+O2(g)=2CO(g)△H=-221kJ/mol,则C的燃烧热为110.5kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞试液变红的溶液中:S2-、SO42-、SO32-、Na+ | |
| B. | 由水电离出来的c(H+)=10-12mol/L的溶液中:Na+、HCO3-、SO42-、K+ | |
| C. | pH=0的溶液中:Na+、K+、Fe2+、NO3- | |
| D. | pH=7的溶液中:Al3+、Cl-、SO42-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
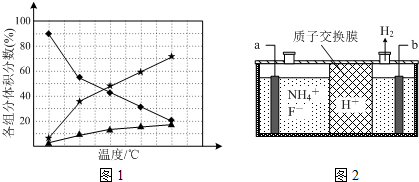
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
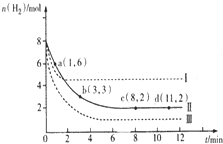 固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:
固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图所示:
A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com