
分析 (1)H2O(l)=H2O(g)△H1=44.0kJ•mol-1 (i)
N2(g)+O2(g)=2NO(g)△H2=229.3kJ•mol-1 (ii)
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H3=-906.5kJ•mol-1 (iii)
由盖斯定律可知(iii)-(ii)×5-(i)×6得:4NH3(g)+6NO(g)=5N2(g)+6H2O(l);
(2)①依据题意,反应物为Co2+与肼(N2H4)、碱性条件下存在OH-,生成物为:钴单质,据此得出Co的化合价降低,故N的化合价升高,只能为0价,即氮气,依据氧化还原反应得失电子守恒回答即可;
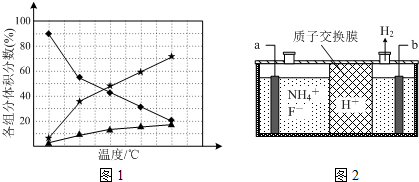
②使湿润的红色石蕊试纸变蓝的气体为氨气,由图1得知:温度越高,肼的百分含量越低,即分解的越快;
(3)①氮化硅中N的非金属性强于Si,Si显+4价,故N显-3价,据此书写化学式;
②由图2可知,氢离子在b极得到电子生成氢气,故b为阴极,那么a为阳极,据此解答即可.
解答 解:(1)H2O(l)=H2O(g)△H1=44.0kJ•mol-1 (i)
N2(g)+O2(g)=2NO(g)△H2=229.3kJ•mol-1 (ii)
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H3=-906.5kJ•mol-1 (iii)
(iii)-(ii)×5-(i)×6得:4NH3(g)+6NO(g)=5N2(g)+6H2O(l),故△H4=-906.5-(229.3×5)-(44×6)=-2317kJ•mol-1,
故答案为:-2317;
(2)①依据题意,反应物为Co2+与肼(N2H4)、碱性条件下存在OH-,生成物为:钴单质,据此得出Co的化合价降低,故N的化合价升高,只能为0价,即氮气,据此得出还有水生成,氧化还原反应中存在得失电子守恒以及元素守恒,故此反应的离子反应方程式为:2Co2++N2H4+4OH-=2Co↓+N2↑+4H2O,
故答案为:2Co2++N2H4+4OH-=2Co↓+N2↑+4H2O;
②使湿润的红色石蕊试纸变蓝的气体为氨气,即肼分解生成氨气,依据元素守恒得知另外一种产物为氮气,故化学反应方程式为:3N2H4$?_{△}^{催化剂}$N2+4NH3,由图1可知,温度越高,肼的体积分数含量越低,故要抑制肼的分解,应降低反应温度,故答案为:3N2H4$?_{△}^{催化剂}$N2+4NH3;降低反应温度;
(3)①氮化硅中N的非金属性强于Si,Si显+4价,故N显-3价,故氮化硅的化学式为:Si3N4,故答案为:Si3N4;
②由图2可知,氢离子在b极得到电子生成氢气,故b为阴极,那么a为阳极,阳极上铵根失去电子生成NF3,电极反应方程式为:NH4++3F--6e-=NF3+4H+,依据电解原理可知,氟离子也可能失去电子生成氟单质,故氧化性较强的单质为氟气,故答案为:阳;NH4++3F--6e-=NF3+4H+;F2.
点评 本题考查较为综合,涉及盖斯定律的应用、氧化还原反应方程式书写、电解池反应原理等知识,为高频考点,侧重于学生的分析、计算能力的考查,综合性较强,难度较大,注意相关知识的整理归纳.


科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①③④ | C. | ②③ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4amol•L-1 | B. | 0.8amol•L-1 | C. | 1.6a mol•L-1 | D. | 1.8a mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量比1:1 | B. | 原子数比1:1 | C. | 分子数比1:1 | D. | 密度比1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当该电池消耗1mol锌时,与CH4燃料电池消耗0.25molCH4产生电量相等 | |
| B. | 该电池二氧化锰为正极,发生氧化反应 | |
| C. | 当0.1mol Zn完全溶解时,电池外电路转移的电子个数约为1.204×1023 | |
| D. | 电池正极反应式为MnO2+e-+H2O═MnO(OH)+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol•L-1的氨水中含有的NH3分子数为0.1NA | |
| B. | 标准状况下,2.24L的CCl4中含有的C-Cl键数为0.4NA | |
| C. | 常温常压下,3.0g葡萄糖和冰醋酸的混合物中含有的原子总数为0.4NA | |
| D. | 标准状况下,Na2O2与足量CO2反应生成2.24L O2,转移电子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用容量瓶配制溶液,定容时俯视刻度线所配溶液浓度偏大 | |
| B. | 铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 | |
| C. | 在电解精炼粗铜的过程中,当转移电子数为NA时,阳极溶解32g | |
| D. | 催化剂通过降低化学反应的焓变加快化学反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com