
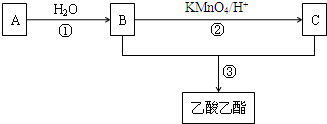


科目:高中化学 来源: 题型:
| A、10倍 | ||
| B、20倍 | ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水电离:NH3?H2O=NH4++OH- |
| B、碳酸钙电离:CaCO3?Ca2++CO32- |
| C、硫酸铝水解:Al3++2H2O=Al(OH)3↓+3OH- |
| D、AgCl的沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| (1)草 酸晶体 | 分子式 | H2C2O4?2H2O | 颜色 | 无色晶体 | ||
| 熔点 | 100.1℃ | 受热至100.1℃时失去结晶水,成为无水草酸. | ||||
| (2)无 水草酸 | 结构简式 | HOOC-COOH | 溶解性 | 能溶于水或乙醇 | ||
| 特性 | 大约在157℃升华(175℃以上发生分解). | |||||
| 化学性质 | H2C2O4+Ba(OH)2=BaC2O4↓+2H2O | |||||
HOOC-COOH
| ||||||
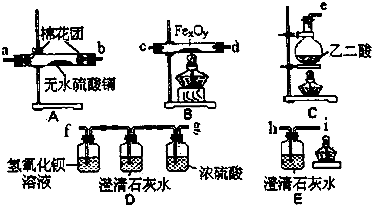
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO3的分解率为20% |
| B、10min内用O2表示的该反应的反应速率为0.005mol/(L?min) |
| C、容器内气体的密度为40g/L |
| D、达到平衡时分解的Ag2SO4固体为0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
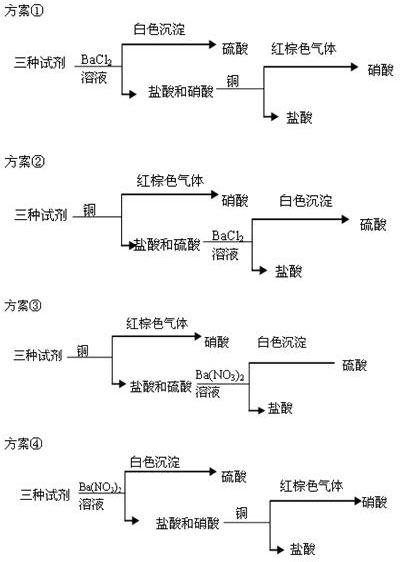
查看答案和解析>>
科目:高中化学 来源: 题型:
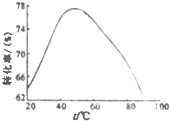 蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
蛇纹石可用于生产氢氧化镁,简要工艺流程如下:| Fe3+ | Al3+ | Fe2- | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
| 平行测定数据 | 平均值 | ||||
| 实验编号 | 1 | 2 | 3 | 4 | |
| 消耗H2O2溶液的体积/mL | 0.32 | 0.30 | 0.30 | 0.32 | 0.31 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com