
(12分) 氮化硅硬度大、熔点高、不溶于酸(氢氟酸除外),是一种重要的结构陶瓷材料。一种用工业硅(含少量钾、钠、铁、铜的氧化物),已知硅的熔点是1420℃,高温下氧气及水蒸气能明显腐蚀氮化硅。一种合成氮化硅的工艺主要流程如下:

(1)净化N2和H2时,铜屑的作用是: ;硅胶的作用是 。
(2)在氮化炉中3SiO2(s)+2N2(g)=Si3N4(s) △H=-727.5kJ/mol,开始时为什么要严格控制氮气的流速以控制温度: ;体系中要通入适量的氢气是为了 。
(3)X可能是 (选填:“盐酸”、“硝酸”、“硫酸”、“氢氟酸”)。
(4)用硅粉作硅源、叠氮化钠(NaN3)作氮源,直接燃烧生成氮化硅(发生置换反应),该反应的化学方程式为: 。
(1)除去原料气中的氧气(2分);除去生成的水蒸气(2分)。
(2)这是放热反应,防止局部过热,导致硅熔化熔合成团,阻碍与N2的接触(2分);
将体系中的氧气转化为水蒸气,而易被除去(若答将整个体系中空气排尽也可得分)(2分)。
(3)硝酸(2分) (4)9Si+4NaN3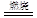 3Si3N4
+4Na↑(2分)
3Si3N4
+4Na↑(2分)
【解析】(1)由于氧气和水蒸气都能腐蚀氮化硅,而氮气和氢气中含有水蒸气和氧气,所以铜屑的作用是除去氧气,硅胶是除去水蒸气的。
(2)因为这是放热反应,如果温度过高,局部过热,会导致硅熔化熔合成团,阻碍与N2的接触;通入氢气能将体系中的氧气转化为水蒸气,而易被除去。
(3)由于关于硅中含有铜的氧化物,在反应中氧化铜能被还原生成铜,因此要除去铜应该选择硝酸,盐酸和硫酸不能溶解铜,氢氟酸能腐蚀氮化硅。
(4)由于是置换反应,所以另一种生成物是钠,方程式未9Si+4NaN3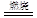 3Si3N4
+4Na↑。
3Si3N4
+4Na↑。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2013学年江西省德兴一中、横峰中学、铅山一中、弋阳一中高一第三次月考化学试卷(带解析) 题型:填空题
(10分)硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷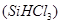 还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
还原法是当前制备高纯硅的主要方法,生产过程示意图如下: 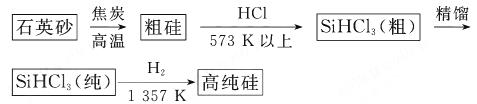
①写出由纯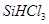 制备高纯硅的化学方程式: 。
制备高纯硅的化学方程式: 。
②整个制备过程必须严格控制无水无氧。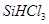 遇水剧烈反应生成
遇水剧烈反应生成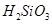 、HCl和另一种物质,配平后的化学反应方程式为? ;
、HCl和另一种物质,配平后的化学反应方程式为? ;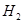 还原
还原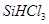 过程中若混入
过程中若混入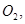 可能引起的后果是? 。
可能引起的后果是? 。
(2)下列有关硅材料的说法正确的是? (填字母)。
| A.碳化硅化学性质稳定,可用于生产耐高温水泥 |
| B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承 |
| C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维 |
| D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高 |
查看答案和解析>>
科目:高中化学 来源:2013届江苏省泗阳致远中学高三实验班第一次模拟考试化学试卷(带解析) 题型:填空题
(12分) 氮化硅硬度大、熔点高、不溶于酸(氢氟酸除外),是一种重要的结构陶瓷材料。一种用工业硅(含少量钾、钠、铁、铜的氧化物),已知硅的熔点是1420℃,高温下氧气及水蒸气能明显腐蚀氮化硅。一种合成氮化硅的工艺主要流程如下:
(1)净化N2和H2时,铜屑的作用是: ;硅胶的作用是 。
(2)在氮化炉中3SiO2(s)+2N2(g)=Si3N4(s) △H=-727.5kJ/mol,开始时为什么要严格控制氮气的流速以控制温度: ;体系中要通入适量的氢气是为了 。
(3)X可能是 (选填:“盐酸”、“硝酸”、“硫酸”、“氢氟酸”)。
(4)用硅粉作硅源、叠氮化钠(NaN3)作氮源,直接燃烧生成氮化硅(发生置换反应),该反应的化学方程式为: 。
查看答案和解析>>
科目:高中化学 来源:2013学年江西省、铅山一中、弋阳一中高一第三次月考化学试卷(解析版) 题型:填空题
(10分)硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷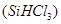 还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
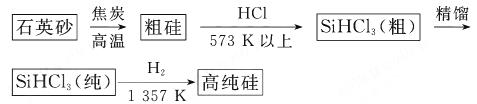
①写出由纯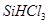 制备高纯硅的化学方程式: 。
制备高纯硅的化学方程式: 。
②整个制备过程必须严格控制无水无氧。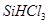 遇水剧烈反应生成
遇水剧烈反应生成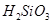 、HCl和另一种物质,配平后的化学反应方程式为? ;
、HCl和另一种物质,配平后的化学反应方程式为? ; 还原
还原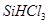 过程中若混入
过程中若混入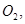 可能引起的后果是? 。
可能引起的后果是? 。
(2)下列有关硅材料的说法正确的是? (填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入稀硝酸,振荡。写出实验现象并给予解释 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)有科学家提出硅是“21世纪的能源”、“未来的石油”,硅单质及其化合物应用范围很广,制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
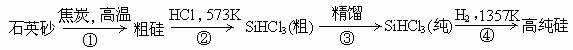
请回答下列问题:
(1)写出第①步的化学反应方程式___________________________;
(2)下列有关硅材料的说法正确的是________________(填字母):
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.硅可做“未来的石油”,可能的原因之一是燃烧放出的热量多,且燃烧产物对环境污染程度低,容易有效控制
C.普通玻璃是由烧碱、石灰石和石英砂制成的,其熔点很高
D.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
E.高纯度硅可直接用于制造高性能通讯材料——光导纤维
F. 氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
(3)SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出该反应的化学方程式_______________________________________;
(4)单质硅遇到氢氧化钠溶液会完全溶解得到无色溶液并放出无色气体,请写出该反应的离子方程式________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com