
 如图是一个电化学过程的示意图,请按要求回答下列问题
如图是一个电化学过程的示意图,请按要求回答下列问题分析 (1)图甲属于燃料电池,通燃料的电极是负极,通氧气的电极是正极,电解池中连接原电池负极的电极为阴极,连接原电池正极的电极为阳极;
(2)碱性燃料电池中氧气得电子产生氢氧根离子,电解池的阴极是银离子得电子发生还原反应,氢氧根在阳极失电子发生氧化反应;
(3)乙池中分别是氢氧根离子放电、银离子放电,是放氧生酸型,据此书写乙池中反应的化学方程式;
(4)根据串联电路中转移电子相等结合电极反应式进行计算;
(5)要恢复电解前的状态,根据析出什么加什么的原则解答.
解答 解:(1)图甲是燃料电池,将化学能转化为电能,属于原电池,通入甲烷的电极为负极,通入氧气的电极为正极,B连接原电池正极,为电解池阳极,铁与电源负极相连作阴极,故答案为:原电池;阳极;
(2)碱性燃料电池中氧气得电子产生氢氧根离子,电极反应式为:O2+4e-+2H2O=4OH-,铁与电源负极相连作阴极,溶液中银离子在阴极A得电子发生还原反应,电极反应式为:Ag++e-=Ag,氢氧根在阳极失电子发生氧化反应,电极反应式为:4OH--4e-=O2↑+2H2O,
故答案为:O2+4e-+2H2O=4OH-;Ag++e-=Ag;4OH--4e-=O2↑+2H2O;
(3)乙池中氢氧根离子在阳极放电、银离子在阴极上放电,则乙池电池反应式为4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4HNO3,
故答案为:4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4HNO3;
(4)甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH4-8e-+10OH-═7H2O+CO32-,消耗1.6g甲烷的物质的量为0.1mol,转移电子0.8mol,根据Ag++e-=Ag,乙池阴极增重银的质量为:0.8mol×108g/mol=86.4g,
故答案为:86.4;
(5)乙池电池反应式为4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4HNO3,向溶液中加入氧化银,氧化银与硝酸反应又生成硝酸银和水,可使溶液恢复到电解前的状况,故答案为:Ag2O.
点评 本题考查了原电池和电解池原理,为高频考点,涉及电极反应式的书写,会结合电解质溶液酸碱性书写电极反应式,再结合转移电子相等进行计算,题目难度不大.


科目:高中化学 来源: 题型:计算题
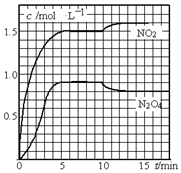 向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用醋酸溶解大理石:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| B. | 向氯化铝溶液中滴加过量氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| C. | 向碳酸氢钙溶液中加入少量烧碱溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+H2O | |
| D. | 亚硫酸钠溶液中滴加酸性高锰酸钾溶液:5SO32-+6H++2MnO4-=5SO42-+2Mn2++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

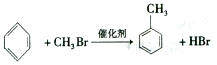 ;②C物质苯环上一卤代物只有两种.
;②C物质苯环上一卤代物只有两种. .
. $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$
 +
+ $→_{△}^{浓硫酸}$H2O+
$→_{△}^{浓硫酸}$H2O+
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
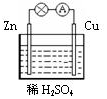
| A. | 锌是该电池的负极 | |
| B. | 锌电极上发生氧化反应 | |
| C. | 铜电极的电极反应式为:2H++2e-=H2↑ | |
| D. | 若将电解质溶液换成AgNO3溶液,两电极的反应式均发生改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com