
分析 (1)物质的能量越高,该物质越不稳定;
(2)C的燃烧为放热反应,完全燃烧放出较多能量;
(3)依据热化学方程式和盖斯定律计算得到,a、N2(g)+2O2(g)=N2O4(g)△H=10.7kJ•mol-1;b、N2H4(g)+O2 (g)=N2(g)+2H2O(g)△H=-543kJ•mol-1,由盖斯定律b×2-a得到;
(4)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,计算1molCO完全燃烧放出的热量,结合热化学方程式的书写方法写出热化学方程式;
(5)根据中和热的概念:稀的强酸和强碱反应生成1mol水所放出的热量求出中和热以及中和热的热化学方程式;
(6)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热.
解答 解:(1)物质的能量越高,该物质越不稳定,C(s.石墨)═C(s.金刚石)△H>0,石墨的能量小于金刚石,所以稳定性石墨>金刚石,故答案为:<;
(2)C的燃烧为放热反应,则△H<0,完全燃烧放出较多能量,放出的能量越多△H越小,则△H1<△H2,故答案为:<;
(3)a、N2(g)+2O2(g)=N2O4(g)△H=10.7kJ•mol-1;b、N2H4(g)+O2 (g)=N2(g)+2H2O(g)△H=-543kJ•mol-1
由盖斯定律b×2-a得到 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1096.7KJ/mol,
故答案为:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1096.7KJ/mol;
(4)1molCO为28g,14gCO在足量的O2中充分燃烧,放出141.3 kJ的热,则1molCO完全燃烧放出282.6kJ热量,CO的燃烧热为△H=-282.6kJ•mol-1,
故答案为:-282.6kJ•mol-1;
(5)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,即生成2mol水放出114.6kJ的热量,反应的反应热为-11.46kJ/mol,中和热为-57.3kJ/mol,故答案为:-57.3kJ/mol;
(6)解:在反应N2+3H2?2NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,即N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1.
点评 本题考查了反应热的计算、热化学方程式和盖斯定律计算应用,为高频考点,侧重考查学生的分析、计算能力的考查,注意把握反应热的计算方法、热化学方程式的书写方法以及盖斯定律的含义,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
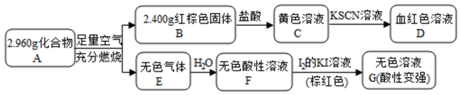
 . 该反应的离子方程式为Fe3S4+6H+=3Fe2++S+3H2S↑.
. 该反应的离子方程式为Fe3S4+6H+=3Fe2++S+3H2S↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B的单质在自然界只有一种核素 | |
| B. | 元素C、D、E的简单离子的半径依次减小 | |
| C. | A、E分别与C形成的化合物中含有一种相同类型的化学键 | |
| D. | 这几种元素可能形成的简单离子中E的简单离子的还原性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是一个电化学过程的示意图,请按要求回答下列问题
如图是一个电化学过程的示意图,请按要求回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液呈碱性,可用于洗去铁屑表面的油污 | |
| B. | 铝易发生钝化,可用于作飞机、火箭的结构材料 | |
| C. | 炭具有还原性,可用于冶炼钠、镁、铝等金属 | |
| D. | 浓硫酸具有强氧化性,可用于干燥二氧化硫气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
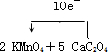
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②向新制得的Na2S溶液中满加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体. |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体. |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉锭. |
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com