
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②向新制得的Na2S溶液中满加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体. |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体. |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉锭. |
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) |
分析 (1)实验目的为同周期元素性质递变规律;
(2)根据实验条件和实验药品的性质判断所需仪器;
(3)①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾,镁与热水反应生成氢气,反应生成氢氧化镁;
②向新制得的Na2S溶液中满加新制的氯水,氯气与Na2S发生氧化还原反应,反应的化学方程式为Na2S+Cl2=2NaCl+S↓;
③因钠的密度比水小,与水剧烈反应生成氢气和氢氧化钠;
④镁较铝活泼,但都能与盐酸发生置换反应,将镁条投入稀盐酸中,剧烈反应,迅速产生大量无色气体;
⑤将铝条投入稀盐酸中,反应不十分剧烈,产生无色气体;
⑥向A1Cl3溶液中滴加NaOH溶液至过量,先生成Al(OH)3沉淀,进而与NaOH反应生成溶于水的NaAlO2.
解答 解:(1)由题目可知,实验目的为同周期元素性质递变规律,
故答案为:同周期;
(2)该试验加水加热至沸腾,则需要酒精灯,金属与水、酸的反应在试管中进行,Na与水的反应一般在烧杯中进行;
故答案为:试管;酒精灯;烧杯;
(3)①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾,镁与热水反应生成氢气,有气泡产生,反应生成氢氧化镁,溶液呈碱性,再向溶液中滴加酚酞溶液,溶液呈红色,反应为MgCl2+2H2O=Mg(OH)2↓+H2↑;
②向新制得的Na2S溶液中满加新制的氯水,氯气与Na2S发生氧化还原反应,反应的化学方程式为Na2S+Cl2=2NaCl+S↓,
③因钠的密度比水小,与水剧烈反应生成氢气和氢氧化钠,氢氧化钠遇酚酞变红,同时反应放热,所以钠浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色,化学方程式为:2Na+2H2O=2NaOH+H2↑;
④镁较铝活泼,但都能与盐酸发生置换反应,将镁条投入稀盐酸中,剧烈反应,迅速产生大量无色气体,
⑤将铝条投入稀盐酸中,反应不十分剧烈,产生无色气体;
⑥向A1Cl3溶液中滴加NaOH溶液至过量,先生成Al(OH)3沉淀,进而与NaOH反应生成溶于水的NaAlO2,反应的离子方程式为Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O,
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) | B | F | A | C | D | E |
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) | B | F | A | C | D | E |
点评 本题考查同周期元素性质递变规律,题目难度中等,注意物质的性质以及元素周期律的递变规律.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
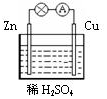
| A. | 锌是该电池的负极 | |
| B. | 锌电极上发生氧化反应 | |
| C. | 铜电极的电极反应式为:2H++2e-=H2↑ | |
| D. | 若将电解质溶液换成AgNO3溶液,两电极的反应式均发生改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 热化学方程式 | 平衡常数 | |
| 500℃ | 700℃ | |
| Ⅰ.2H2(g)+CO(g)?CH3OH(g)△H1=akJ•mol-1 | 2.5 | 0.2 |
| Ⅱ.H2(g)+CO2(g)?H2O(g)+CO(g)△H2=bkJ•mol-1 | 1.0 | 2.3 |
| Ⅲ.3H2(g)+CO2(g)?CH3OH(g)+H2O(g)△H3=ckJ•mol-1 | K3 | 4.6 |
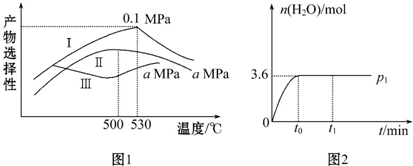
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 共价键 | C-O | H-O | N-H | C-N |
| 键能/kJ•mol-1 | 351 | 463 | 393 | 293 |
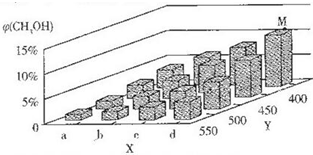

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
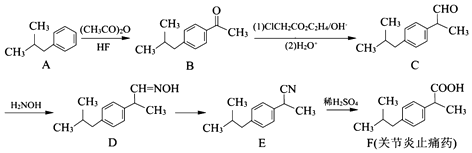
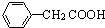 (任写一种);X有多种同分异构体,满足下列条件的X的同分异构体共有3种.
(任写一种);X有多种同分异构体,满足下列条件的X的同分异构体共有3种.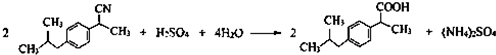 .
.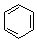 $→_{AlCl_{3}}^{RCl}$
$→_{AlCl_{3}}^{RCl}$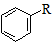

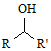 $\stackrel{CO、Pd}{→}$
$\stackrel{CO、Pd}{→}$ R、R′表示烃基
R、R′表示烃基 、苯、(CH3CO)2O为原料来合成,写出有关的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CHOH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.
、苯、(CH3CO)2O为原料来合成,写出有关的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CHOH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com