
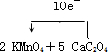
���� ��1��CaC2O4�ڷ�Ӧ��ʧȥ���ӣ�CԪ�ػ��ϼ����ߣ���MnԪ�ػ��ϼ���+7�۱�Ϊ+2�ۣ��ݴ��ж���������
��2���ڱ�״��������11.2L Xʱ�������ʵ���Ϊ0.5mol������ת�Ƶ��ӡ�̼ԭ���غ�ȷ��X��CԪ�ػ��ϼۣ��Ӷ�ȷ��X��ѧʽ��
��3��Cʧȥ���ӣ�Mn�õ����ӣ�ת��10e-��
��4��Cʧȥ���ӣ����л�ԭ�ԣ���������������ԭ��Ӧ�ı���Ϊ����ת�ƣ�
��� �⣺��1��CaC2O4�ڷ�Ӧ��ʧȥ���ӣ�CԪ�ػ��ϼ����ߣ���MnԪ�ػ��ϼ���+7�۱�Ϊ+2�ۣ�������������KMnO4���ʴ�Ϊ��KMnO4��
���ڱ�״��������11.2L Xʱ�������ʵ���Ϊ0.5mol����0.5mol����ת�ƣ�������0.25mol CaC2O4�������IJ���ơ�ת�Ƶ��Ӻ�������������ʵ���֮��=0.25mol��0.5mol��0.5mol=1��2��2������Cԭ���غ�֪������X�����к���1��Cԭ�ӣ�����ת�Ƶ��Ӻ�Cԭ��֮���ϵ����X��CԪ�ػ��ϼ�Ϊa��0.25mol����x-3����2=0.5mol��x=+4������XΪCO2���ʴ�Ϊ��CO2��
��3��������Ϊ������أ���ԭ��ΪCaC2O4���ɵ����غ��֪����2 KMnO4+5 CaC2O4���������ת�Ƶķ������ĿΪ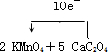 ��
��
�ʴ�Ϊ��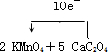 ��
��
��4����Ӧ��CaC2O4���ֻ�ԭ�ԣ�����������Ӧ�������������������ԭ��Ӧ�ı����ǵ��ӵ�ת�ƣ����ӵĵ�ʧ���õ��ӶԵ�ƫ�ƣ���
�ʴ�Ϊ����ԭ�� ���������������ӵ�ת�ƣ����ӵĵ�ʧ���õ��ӶԵ�ƫ�ƣ���
���� ���⿼��������ԭ��Ӧ��Ϊ��Ƶ���㣬���շ����ķ�Ӧ��Ԫ�صĻ��ϼ۱仯Ϊ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע������غ㼰ת�Ƶ��ӵı�ʾ��������Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���廯ѧ�������Ʊ����ײ��� | |
| B�� | �ѺϽ���Ҫ���ڼ������ | |
| C�� | ѹ���մɿ�ʵ�ֻ�ѧ������ܵ�ת�� | |
| D�� | ϡ��Ԫ�ش����ƺϽ����ܱ���Ϊұ��ҵ��ά���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ô����ܽ����ʯ��CaCO3+2H+=Ca2++H2O+CO2�� | |
| B�� | ���Ȼ�����Һ�еμӹ�����ˮ��Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| C�� | ��̼�������Һ�м��������ռ���Һ��Ca2++2HCO3-+2OH-=CaCO3��+CO32-+H2O | |
| D�� | ����������Һ�еμ����Ը��������Һ��5SO32-+6H++2MnO4-=5SO42-+2Mn2++3H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.5 mol���ף�P4���ṹ��ͼ������2NA��P-P�� | |
| B�� | 23g������һ�����������������ã������߾���ʣ�࣬ת��NA������ | |
| C�� | 1mol/L��NH4��2SO4��Һ�У���SO2-4NA����NH+4����2NA�� | |
| D�� | ���³�ѹ��22.4L��CO2��һ����������������þ��Ӧ��ת��4NA������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

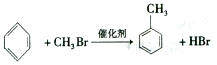 ����C���ʱ�����һ±����ֻ�����֣�
����C���ʱ�����һ±����ֻ�����֣� ��
�� $\stackrel{һ��������}{��}$
$\stackrel{һ��������}{��}$
 +
+ $��_{��}^{Ũ����}$H2O+
$��_{��}^{Ũ����}$H2O+
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ���ۼ� | C-O | H-O | N-H | C-N |
| ����/kJ•mol-1 | 351 | 463 | 393 | 293 |

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com