
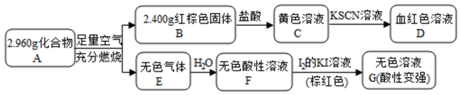
 . 该反应的离子方程式为Fe3S4+6H+=3Fe2++S+3H2S↑.
. 该反应的离子方程式为Fe3S4+6H+=3Fe2++S+3H2S↑. 分析 C加入KSCN,D为血红色溶液,可知C为FeCl3,D为Fe(SCN)3等,可知B为Fe2O3,且n(Fe2O3)=$\frac{2.400g}{160g/mol}$=0.015mol,n(Fe)=0.03mol,m(Fe)=0.03mol×56g/mol=1.68g,A燃烧生成的无色气体E溶液水得到酸性溶液,加入碘的KI溶液,得到无色溶液,说明碘可氧化E的水溶液,E应为SO2,F为H2SO3,G含有和H2SO4和HI,可知A含有Fe、S元素,且m(S)=2.96g-1.68g=1.28g,n(S)=$\frac{1.28g}{32g/mol}$=0.04mol,可知n(Fe):n(S)=3:4,应为Fe3S4,以此解答该题
解答 解:(1)由以上分析可知,A为Fe3S4,B为Fe2O3,E应为SO2,则A煅烧生成B和E的化学方程式为4Fe3S4+25O2$\frac{\underline{\;高温\;}}{\;}$6Fe2O3+16SO2,
故答案为:Fe3S4;4Fe3S4+25O2$\frac{\underline{\;高温\;}}{\;}$6Fe2O3+16SO2;
(2)由以上分析可知,溶液C为FeCl3,可氧化铜,常用于刻饰铜线路板,反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+,
故答案为:2Fe3++Cu=2Fe2++Cu2+;刻饰铜线路板;
(3)化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518g•L-1),淡黄色不溶物为S,气体的相对分子质量为1.518×22.4L=34,为H2S气体,电子式为 ,反应的离子方程式为Fe3S4+6H+=3Fe2++S+3H2S↑,
,反应的离子方程式为Fe3S4+6H+=3Fe2++S+3H2S↑,
故答案为: ;Fe3S4+6H+=3Fe2++S+3H2S↑.
;Fe3S4+6H+=3Fe2++S+3H2S↑.
点评 本题综合考查无机物的推断,为高考常见题型,侧重于学生的分析、计算和实验能力的考查,注意把握物质的性质以及反应现象,结合质量守恒推断物质的组成,难度中等.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:选择题
| A. | Al2(SO4)3═2Al3++3SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | H2O═O2-+2H+ | D. | Na2CO3═Na2++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 碳氧化物研究
碳氧化物研究| CO的转化率 T(℃) | 10min | 20min | 30min | 40min |
| T1 | 20% | 55% | 65% | 65% |
| T2 | 35% | 50% | a1 | a2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第二个反应的平衡常数为1 | |
| B. | 第二个反应的平衡常数为0.05 | |
| C. | 第二个反应达到平衡时,H2的平衡浓度为0.25mol/L | |
| D. | 第二个反应达到平衡时,HI(g)的平衡浓度为0.25 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
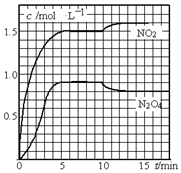 向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X | |
| B. | 最简单氢化物的稳定性:Y>Z | |
| C. | X和W形成的化合物属于离子化合物 | |
| D. | 由X、Y、Z三种元素组成的化合物一定显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体化学可用于制备纳米材料 | |
| B. | 钛合金主要用于尖端领域 | |
| C. | 压电陶瓷可实现化学能与电能的转化 | |
| D. | 稀土元素大大改善合金性能被称为冶金工业的维生素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
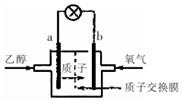 乙醇燃料电池中采用磺酸类质子溶剂,在200℃左右时供电,电池总反应为:
乙醇燃料电池中采用磺酸类质子溶剂,在200℃左右时供电,电池总反应为:| A. | 电池工作时.质子向电池的负极迁移 | |
| B. | 电池工作时.电子由b极沿导线流向a极 | |
| C. | a极上发生的电极反应是:C2H5OH+3H2O+12e一=2CO2+12H+ | |
| D. | -b极上发生的电极反应是:4H++O2+4e一=2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com