
下列各种分子之间不能自身发生化学反应的是( )
A.乙烯 B.乙醇
C.乙烷 D.氯乙烯
科目:高中化学 来源: 题型:
美国宇航局将在2012年再次登陆火星,新火星车体积更大、功能更全,旨在探寻火星土壤中是否存在有机物。已有资料表明:火星表面富含硅酸盐和硫酸盐;火星上的水以冰块和霜冻的形式存在于南北两极。下列叙述不正确的是( )
A.硅酸盐、硫酸盐都是含氧酸盐
B.水玻璃是混合物,冰水混合物是纯净物
C.Al2O3·2SiO2·2H2O属于氧化物
D.硅酸钠、硫酸钡、水分别属于强电解质、强电解质、弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且 的值与温度高低有关。当n(KOH)=a mol时,下列有关说法错误的是( )
的值与温度高低有关。当n(KOH)=a mol时,下列有关说法错误的是( )
A.若某温度下,反应后 =11,则溶液中
=11,则溶液中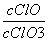 =
=
B.参加反应的氯气的物质的量等于 a mol
a mol
C.改变温度,反应中转移电子的物质的量ne的范围: a mol≤ne≤
a mol≤ne≤ a mol
a mol
D.改变温度,产物中KClO3的最大理论产量为 a mol
a mol
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应Cr2O +3SO
+3SO +aH+===2Cr3++3Y+4H2O,下列说法不正确的是( )
+aH+===2Cr3++3Y+4H2O,下列说法不正确的是( )
A.Y是SO
B.a=8
C.Cr2O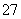 被氧化成Cr3+
被氧化成Cr3+
D.生成1 mol Cr3+时,转移的电子数是3×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
用硫酸酸化的CrO3遇酒精后,其颜色会从红色变为蓝绿色,用这个现象可以测得汽车司机是否酒后驾车。反应的方程式为:2CrO3+3CH3CH2OH+3H2SO4===Cr2(SO4)3+3CH3CHO+6H2O 此反应的氧化剂是( )
A.H2SO4 B.CrO3
C.Cr2(SO4)3 D.CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
为了测定乙醇的结构式,有人设计了用无水酒精与钠反应的实验装置和测定氢气体积的装置进行实验。可供选用的实验仪器如图所示。
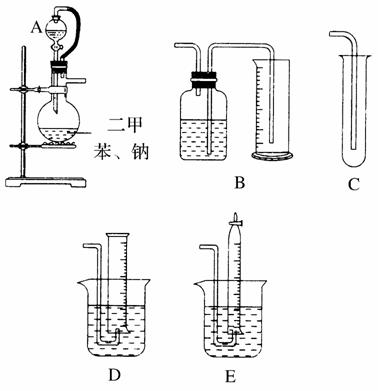
请回答以下问题:
(1)测量氢气体积的正确装置是________(填写编号)。
(2)装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是________(填写编号)。
A.防止无水酒精挥发
B.保证实验装置不漏气
C.使无水酒精容易滴下
(3)实验前预先将小块钠在二甲苯中熔化成小钠珠,冷却后倒入烧瓶中,其目的是______________________________________。
(4)已知无水酒精的密度为0.789g·cm-3,称取2.0mL酒精,反应完全后(钠过量),收集390mL气体。则乙醇分子中能被钠取代出的氢原子数为________,由此可确定乙醇的结构式为________,而不是________。
(5)实验所测定的结果偏高,可能引起的原因是________(填写编号)。
A.本实验在室温下进行
B.无水酒精中混有微量甲醇
C.无水酒精与钠的反应不够完全
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于原子结构、元素性质的说法正确的是
A.随着原子序数的递增,元素原子的核外电子数增多,原子半径逐渐减小
B.若两种不同核素具有相同的中子数,则二者一定不属于同种元素
C.若两种元素的原子的最外层电子数相同,则元素的最高正价一定相同
D.电子层结构相同的微粒,其化学性质一定相似
查看答案和解析>>
科目:高中化学 来源: 题型:
过氧化钙(CaO2)在日常生活和工农业生产中常用于种子消毒、药物制造、鱼池增氧等。过氧化钙在常温下是白色或淡黄色粉末,易溶于酸,难溶于水、乙醇等溶剂。某实验小组在实验室用钙盐制取CaO2·8H2O(该反应为放热反应)。
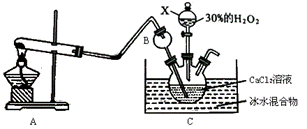
Ⅰ、第一部分:
(1)仪器B的名称为____________,作用是______________________。
(2)A为实验室制取氨气的装置,写出A中发生反应的化学方程式_______________。
(3)制取CaO2·8H2O一般在0℃~5℃的低温下进行,原因是________________;写出生成CaO2·8H2O的化学方程式________________________________________________。
Ⅱ、第二部分:
欲测定产品中CaO2的含量,实验步骤是:已知:I2 + 2S2O32- = 2I- + S4O62-
第一步:准确称取a g产品于锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
(4)判断此滴定实验达到终点的方法是: 。
(5)CaO2的质量分数为 (用字母表示);
(6)某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能 (填“无影响”、“偏低”或“偏高”)。[来源:Z|xx|k.Com]
查看答案和解析>>
科目:高中化学 来源: 题型:
离子液体是一种室温熔融盐,为非水体系。由有机阳离子、Al2Cl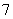 和AlCl
和AlCl 组成的离子液体作电解液时,可在钢制品上电镀铝。
组成的离子液体作电解液时,可在钢制品上电镀铝。
(1)钢制品接电源的________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为__________________________________________。若改用AlCl3水溶液作电解液,则阴极产物为________。
(2)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为________mol。
(3)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有________。
a.KCl b.KClO3 c.MnO2 d.Mg
取少量铝热反应所得的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,______________(填“能”或“ 不能”)说明固体混合物中无Fe2O3,理由是________(用离子方程式说明)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com