
【题目】闪电时空气中有臭氧生成。下列说法正确的是
A. O3和O2互为同位素
B. O3与O2的相互转变是物理变化
C. 相同状况下,等体积O3和O2含有相同质子数
D. O3比O2氧化性更强
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料。从天然气获得合成气过程中可能发生的反应有:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=206.1 kJ·mol-1
CO(g)+3H2(g) ΔH1=206.1 kJ·mol-1
②CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH2=247.3 kJ·mol-1
2CO(g)+2H2(g) ΔH2=247.3 kJ·mol-1
③CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示。反应进行的前5 min内,v(H2)= ;10 min时,改变的外界条件可能是 。
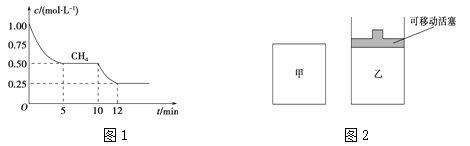
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。
①可以判断甲容器中反应已达平衡状态的是 。
a.生成CH4的速率是生成CO的速率的2倍
b.容器内压强保持不变
c.容器内气体的密度保持不变
d.容器内各气体的浓度保持不变
②甲乙两容器中反应达到平衡时,下列说法正确的是 。
a.化学反应速率:v (甲)>v (乙)
b.甲烷的转化率:α(甲)<α(乙)
c.压强:P(甲)= P (乙)
(3)反应③中ΔH3= kJ·mol-1。800 ℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO | H2O | CO2 | H2 |
0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
此时反应③中正、逆反应速率的关系是 (填代号)。
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中含有苯酚,实验操作是___________________________________________________。从废水中回收苯酚的方法是:①取有机溶剂萃取废液中的苯酚;②加入某种药品的水溶液使苯酚从有机溶剂中脱离;③通入某物质又析出苯酚。试写出②、③步的化学方程式__________。
(2)某醛的结构简式为 
检验分子中醛基的所用的试剂是________________,化学方程式为____________;然后往反应后的溶液中加入稀硫酸至溶液呈酸性,再滴加足量的溴水,检验分子中碳碳双键,生成的有机产物的结构简式是____________;
(3)做过银镜反应的试管内壁的一层银,可用_________除去。(写化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数值。下列有关叙述正确的是
A.14g乙烯和丙烯混合气体中的氢原子数为2 NA
B.1molFe溶于过量硝酸,电子转移数为2NA
C.18g水中含有2NA个氢键
D.标准状况下,2.24LCCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜单质及其化合物在很多领域中都有重要的用途。请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:
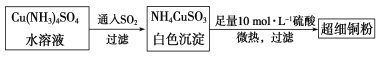
①NH4CuSO3中金属阳离子的核外电子排布式为______。N、O、S三种元素的第一电离能大小顺序为______________(填元素符号)。
②SO42-的空间构型为________,与SO42-互为等电子体的有机分子的化学式为_________。
(2)某学生用硫酸铜溶液与氨水做了一组实验,CuSO4溶液中加氨水生成蓝色沉淀,再加氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,请解释加入乙醇后析出晶体的原因_______________;在该晶体中存在的化学键的种类有_____________。
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图所示),a位置上Cl原子的杂化轨道类型为________。已知其中一种化合物的化学式为KCuCl3,则另一种化合物的化学式为____________。
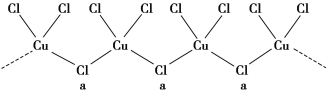
(4)用晶体的X射线衍射法可以测得阿伏加德罗常数的值。对金属铜的测定得到以下结果:铜晶胞为面心立方最密堆积,边长为361 pm。又知铜的密度为9.00 g·cm-3,则铜原子的直径约为__________pm,求算阿伏加德罗常数的表达式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用实验室制溴苯的废催化剂FeBr3作原料,制取溴的苯溶液和无水FeCl3。下列设计能达到相应实验目的的是
A.用装置甲制取氯气
B.用装置乙氧化FeBr3溶液中的溴离子
C.用装置丙分液时先从下口放出水相,再从上口倒出有机相
D.用装置丁将分液后的水相蒸发至干,再灼烧制得无水FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气和氮气一定条件下反应生成氨气。已知 H-H 键、N≡N、H-N 键能分别为Q1、Q2 、Q3 kJmol-1。下列关系式中正确的是
A.3Q1 + 3Q2 < 2Q3
B.Q1+Q2 < Q3
C.3Q1 + Q2 < 6 Q3
D.3Q1 + Q2 < 2Q3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com