
【题目】(1)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中含有苯酚,实验操作是___________________________________________________。从废水中回收苯酚的方法是:①取有机溶剂萃取废液中的苯酚;②加入某种药品的水溶液使苯酚从有机溶剂中脱离;③通入某物质又析出苯酚。试写出②、③步的化学方程式__________。
(2)某醛的结构简式为 
检验分子中醛基的所用的试剂是________________,化学方程式为____________;然后往反应后的溶液中加入稀硫酸至溶液呈酸性,再滴加足量的溴水,检验分子中碳碳双键,生成的有机产物的结构简式是____________;
(3)做过银镜反应的试管内壁的一层银,可用_________除去。(写化学式)
【答案】(1)取少量废液于试管中,滴加少量FeCl3溶液,溶液变紫色,说明废液中含有苯酚。
![]() 、
、![]()
(2)稀氨水、AgNO3溶液 ;![]()
或者:新制Cu(OH)2; ;
;
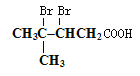 (3)HNO3
(3)HNO3
【解析】
试题分析:(1)苯酚的检验可利用其特征性质,例如与浓溴水或FeC13溶液等反应,则实验操作是取少量废液于试管中,滴加少量FeCl3溶液,溶液变紫色,说明废液中含有苯酚;萃取剂既要溶解苯酚,又要与水不互溶,用苯萃取再用NaOH溶液使苯酚变成水溶性苯酚钠从苯中分离出来,最后向苯酚钠中通酸性气体(CO2),则可析出苯酚,化学方程式为![]() 、
、![]() 。
。
(2)检验醛基可以加入银氨溶液(稀氨水、AgNO3溶液)后,水浴加热有银镜生成,可证明有醛基,反应的方程式为:![]() ,还可以用新制氢氧化铜,方程式为
,还可以用新制氢氧化铜,方程式为 ;检验碳碳双键,可用溴水,但醛基也可与溴水发生氧化反应而使溴水褪色,则应先加入银氨溶液氧化-CHO成-COOH后,调pH至中性再加入溴水,碳碳双键与溴水发生加成反应,则生成的有机产物的结构简式是
;检验碳碳双键,可用溴水,但醛基也可与溴水发生氧化反应而使溴水褪色,则应先加入银氨溶液氧化-CHO成-COOH后,调pH至中性再加入溴水,碳碳双键与溴水发生加成反应,则生成的有机产物的结构简式是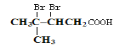 。
。
(3)银是不活泼金属,能与硝酸反应生成硝酸银、氮的氧化物和水,则做过银镜反应的试管内壁的一层银,可用HNO3除去


科目:高中化学 来源: 题型:
【题目】科学研究与工业生产中常常用到溶液中的反应。
(1)25℃时,0.05 mol·L-1Ba(OH)2溶液的pH= ,将该Ba(OH)2溶液与pH=2的HCl溶液混合,若所得混合溶液pH=7,则Ba(OH)2溶液与HCl溶液的体积比为 。
(2)CO2可转化成有机物实现碳循环:CO2![]() CH3OH
CH3OH![]() HCOOH……
HCOOH……
25 ℃时,几种酸的电离平衡常数如下:
化学式 | HCOOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-4 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
①用离子方程式表示HCOONa溶液呈碱性的原因 。
②物质的量浓度均为0.1 mol·L-1的下列四种物质:
a.Na2CO3 b.NaClO c.HCOONa d.NaHCO3 ,pH由大到小的顺序是 (填编号)。
(3)常温下,将0.2 mol·L-1的HCOOH和0.1 mol·L-1的NaOH溶液等体积混合,所得溶液的pH<7,说明所得混合溶液中HCOOH的电离程度 HCOONa的水解程度(填“大于”“等于”或“小于”)。
(4)含有Cr2O72-的废水毒性较大,某工厂废水中含5.00×10-3 mol·L-1的Cr2O72-。为使废水能达标排放,做如下处理:Cr2O72-![]() Cr3+、Fe3+
Cr3+、Fe3+![]() Cr(OH)3、Fe(OH)3。若处理后的废水中残留的c(Fe3+)=2×10-13 mol·L-1,则残留的Cr3+的浓度为 mol·L-1 (已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。
Cr(OH)3、Fe(OH)3。若处理后的废水中残留的c(Fe3+)=2×10-13 mol·L-1,则残留的Cr3+的浓度为 mol·L-1 (已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若用乙烯和氯气在适当的条件下反应制取三氯乙烷,这一过程中所发生的反应的类型及消耗氯气的量是(设乙烯为1 mol,反应产物中的有机物只有三氯乙烷)
A.取代反应,4 mol Cl2
B.加成反应,2 mol Cl2
C.加成反应、取代反应,3 mol Cl2
D.加成反应、取代反应,2 mol Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列性质递变规律错误的是
A. 金属性:K>Na>Li
B. 酸性:HClO3>H2SO4>H3PO4
C. 还原性:I->Br->Cl-
D. 氧化性:F2>Cl2>Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、已知在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热。现利用下图装置进行中和热的测定,请回答下列问题:
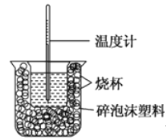
(1)该图中有两处未画出,它们分别是______、______。
(2)做一次完整的中和热测定实验,温度计需使用______次。
(3)把温度为13℃,浓度为1.0mol/L的酸溶液和1.1mol/L的碱溶液各50mL混合(溶液密度均为1g/mL),生成溶液的比热容c=4.184J/(g℃),轻轻搅动,测得酸碱混合液的温度变化数据如下:
反应物 | 起始温度t1/℃ | 终止温度t2/℃ | 中和热 |
HCl+NaOH | 13 | 19.8 | △H1 |
HCl+NH3H2O | 13 | 19.3 | △H2 |
①比较△H1和△H2的相对大小:△H1 △H2(填“>”“<”或“=”)。
②两组实验结果差异的原因是 。
③写出HCl和NH3H2O反应的热化学方程式: 。
II、如下图所示:用两张圆形滤纸分别折叠成漏斗状,套在一起,使四周都有四层。把内层滤纸取出,在底部剪一个小孔,用水润湿,再跟另一纸漏斗套在一起,架在铁圈上,下面放置一盛沙的蒸发皿。把5 g干燥的氧化铁粉末和2 g铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条。观察发生的现象。通过以上实验信息,回答下列问题:
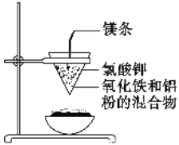
(1)写出该反应的化学方程式:__________,该反应称为________反应。
(2)选出该实验的实验现象(填写在横线上):________。
①镁条剧烈燃烧 ②放出大量的热,并发出耀眼的光芒,火星四射
③纸漏斗的下部被烧穿 ④有红热状态的液珠落入蒸发皿内的细沙上,液珠冷却后变为黑色固体
(3)写出各物质的作用:蒸发皿盛沙:________;镁条:________;氯酸钾:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】闪电时空气中有臭氧生成。下列说法正确的是
A. O3和O2互为同位素
B. O3与O2的相互转变是物理变化
C. 相同状况下,等体积O3和O2含有相同质子数
D. O3比O2氧化性更强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物在O2中充分燃烧,生成CO2和H2O的物质的量比为2∶5,下列说法正确的是
A.分子中C、H、O个数之比为2∶10∶9
B.分子中C、H个数之比为2∶5
C.该有机物可能为烃
D.此有机物的最简式为CH5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z 为不同短周期非金属元素的气态单质。在一定条件下能发生如下反应:
Y+X → 甲(g),Y+Z → 乙(g)。甲、乙可化合生成离子化合物,甲的相对分子质量小于乙。
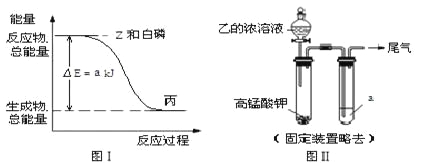
(1)X 的电子式是__________。
(2)白磷(P4)在 Z 气体中燃烧可生成液态丙分子,也可生成固态丁分子。已知丙分子中各原子最外层均是 8 电子结构,丙的结构式是__________。 白磷固体和 Z 气体反应,生成 1 mol 液态丙时,能量变化如图Ⅰ所示,写出该反应的热化学方程式: ___________ _________。已知 1 mol 白磷固体和 Z 气体反应,生成固态丁时,放热 b kJ,则 1 mol 固态丁转化为液态丙时的反应热△H =____________________。
(3)某同学拟用图Ⅱ所示装置证明氧化性Z>I2,已知高锰酸钾与乙的浓溶液反应生成Z,则 a ___ 的水溶液。若仅将 a 换为甲的浓溶液,实验时会产生大量白烟并有气体单质生成,该反应的化学方程式是____________________。
(4)向一定浓度的 BaCl2溶液中通入 SO2气体,未见沉淀生成,若在通入 SO2气体的同时加入由 X、 Y、Z 中的一种或几种元素组成的某纯净物,即可生成白色沉淀,该纯净物可能是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com