
【题目】硫酸锌被广泛应用于医药领域和工农业生产。工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO47H2O的一种流程如图:
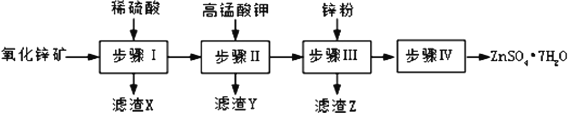
(1)步骤Ⅰ的操作是____________。
(2)步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为____________________________________。
(3)步骤Ⅲ中,加入锌粉的作用是______________。
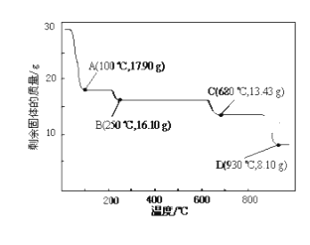
(4)取28.70 g ZnSO47H2O加热至不同温度,剩余固体的质量变化如下图所示。实验室中应置于____________(填仪器名称)焙烧样品。分析数据,100℃时发生反应的化学方程式为 ______________________________;680℃时所得固体的化学式为__________(填字母符号)。
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4H2O
【答案】过滤 3Fe2++MnO4-+8H2O=3Fe(OH)3↓+MnO(OH)2↓+5H+ 除去Cu2+ 坩埚 ZnSO47H2O![]() ZnSO4 H2O+6H2O b
ZnSO4 H2O+6H2O b
【解析】
氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)加稀硫酸溶解,过滤,滤液中含有硫酸锌、硫酸铜、硫酸亚铁,再加高锰酸钾溶液与亚铁离子反应生成 MnO(OH)2和氢氧化铁沉淀,过滤,滤液中含有硫酸铜和硫酸锌,加锌粉置换铜离子,过滤,滤渣为Cu可能含有Zn,滤液为硫酸锌和硫酸钾,蒸发浓缩、冷却结晶、过滤得到ZnSO47H2O晶体;据以上分析解答。
氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)加稀硫酸溶解,过滤,滤液中含有硫酸锌、硫酸铜、硫酸亚铁,再加高锰酸钾溶液与亚铁离子反应生成 MnO(OH)2和氢氧化铁沉淀,过滤,滤液中含有硫酸铜和硫酸锌,加锌粉置换铜离子,过滤,滤渣为Cu可能含有Zn,滤液为硫酸锌和硫酸钾,蒸发浓缩、冷却结晶、过滤得到ZnSO47H2O晶体;
(1)ZnSiO3与稀硫酸反应生成硅酸不溶于水,分离滤渣和溶液通常用过滤的方法。综上所述,本题答案是:过滤。
(2)在pH约为5.1的滤液中加入高锰酸钾,高锰酸钾与Fe2+发生氧化还原反应,生成 Fe(OH)3和MnO(OH)2两种沉淀,则反应的离子方程式为:3Fe2++MnO4-+8H2O=3Fe(OH)3↓+MnO(OH)2↓+5H+;综上所述,本题答案是:3Fe2++MnO4-+8H2O=3Fe(OH)3↓+MnO(OH)2↓+5H+。
(3)步骤Ⅲ中,向滤液中加入锌粉,可以与Cu2+反应置换出铜,从而除去Cu2+;综上所述,本题答案是:除去Cu2+。
(4)实验室中焙烧样品应该在坩埚中进行;设ZnSO47H2O在100℃时分解为ZnSO4(7-x)H2O和H2O;根据方程式可知:
ZnSO47H2O![]() ZnSO4 (7-x)H2O+ x H2O;
ZnSO4 (7-x)H2O+ x H2O;
287 固体质量减小18x
28.7 固体质量减小 28.7-17.9
解之得x=6,即加热分解后生成ZnSO4 H2O,所以该反应的方程式为ZnSO47H2O![]() ZnSO4 H2O+6H2O;28.70g ZnSO47H2O的物质的量为28.7/287=0.1mol,由Zn元素守恒可以知道,生成ZnSO4H2O或ZnSO4或ZnO时,物质的量均为0.1mol,若生成Zn3O(SO4)2时,其物质的量为0.1/3=1/30mol;
ZnSO4 H2O+6H2O;28.70g ZnSO47H2O的物质的量为28.7/287=0.1mol,由Zn元素守恒可以知道,生成ZnSO4H2O或ZnSO4或ZnO时,物质的量均为0.1mol,若生成Zn3O(SO4)2时,其物质的量为0.1/3=1/30mol;
a项,若得ZnO,其质量为0.1×81=8.10g,对应的温度为930℃,故不选a项;
b项,若生成Zn3O(SO4)2,其质量为1/30×403=13.43g,对应温度为680℃,故选b项;
c项,若得ZnSO4,其质量为0.1×161=16.10g,对应温度为250℃,故不选c项;
d项,若得ZnSO4H2O,其质量为其质量为0.1×179=17.9g ,对应温度为100℃,故不选d项。
结合以上分析可知,本题选b。
综上所述,本题答案是:坩埚; ZnSO47H2O![]() ZnSO4 H2O+6H2O ;b。
ZnSO4 H2O+6H2O ;b。


科目:高中化学 来源: 题型:
【题目】(1) 请计算 68.4g 蔗糖完全水解生成葡萄糖的物质的量是多少___________。
(2)葡萄糖在酒化酶的作用下可以分解为酒精和二氧化碳。请计算用 684g 蔗糖为原料制取葡萄糖,并由葡萄糖完全转化为酒精,生成酒精的物质的量是多少___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)![]() CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。
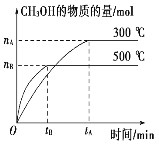
(1)该反应的平衡常数表达式K=_______;
(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表 示的化学反应速率是______(用 nB,tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是_________(填字母,下同)。
a.v生成(CH3OH)=v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度均不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,向V L密闭容器中加入0.5 mol NO和0.5 mol活性炭,发生反应:
2NO(g)+C(s)![]() N2(g)+CO2(g) △H= —Q kJ·mol-1(Q>0),达到平衡时的数据如下:
N2(g)+CO2(g) △H= —Q kJ·mol-1(Q>0),达到平衡时的数据如下:
温度/℃ | n (C)/mol | n(CO2)/mol |
T1 | 0.15 | |
T2 | 0.375 |
下列有关说法正确的是
A. 由上述信息可推知:T1 > T2
B. T2℃时,若反应达平衡后再缩小容器的体积,c (N2):c (NO)增大
C. T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率增大
D. T1℃时,该反应的平衡常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A. 对于2HI(g)![]() H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
B. 已知, N2 (g) + 3 H2(g)![]() 2NH3(g) △H﹤0 ,为提高氨的产率,理论上应采取降低温度的措施
2NH3(g) △H﹤0 ,为提高氨的产率,理论上应采取降低温度的措施
C. 反应CO(g)+NO2(g)![]() CO2(g)+NO(g)△H﹤0,达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)△H﹤0,达平衡后,升高温度体系颜色变深
D. 溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对恒温恒容密闭容器中的可逆反应:A(g)+3B(g)![]() 2C(g) H <0,下列错误的是( )
2C(g) H <0,下列错误的是( )
A. 升高温度,v(正)、v(逆)都增大,但v(逆)增加的程度更大
B. 增大压强,v(正)、v(逆)都增大,但v(正)增加的程度更大
C. 增大A的浓度,v(正)会增大,但v(逆)会减小
D. 使用催化剂,一般v(正)、v(逆)同时增大,而且增大的倍数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述正确的是

A. 图甲表示有无催化剂的反应,加催化剂可以改变反应的焓变
B. 图乙表示等浓度等体积的NaCl、NaBr及NaI溶液分别用AgNO3溶液滴定曲线,a为Cl-
C. 图丙表示等浓度等体积的盐酸和醋酸分别用NaOH溶液的滴定曲线,指示剂都可用酚酞
D. 图丁表示反应2CO(g)+2NO(g)![]() N2(g)+2CO2(g),在其他条件不变时,改变起始CO的物质的量,平衡时N2的体积分数变化,由图可知NO的转化率b>c>a
N2(g)+2CO2(g),在其他条件不变时,改变起始CO的物质的量,平衡时N2的体积分数变化,由图可知NO的转化率b>c>a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com