
 O的质量之比。
O的质量之比。 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源:不详 题型:实验题
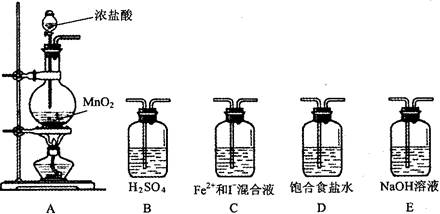
| 实验步骤 | 预期现象和结论 |
| 取少量反应后的混合溶液分置于A、B两试管中; 往A中滴加__________溶液 往B中滴加__________溶液 | ①若_______________________________ ________________________,则假设1成立 ②若____________________________ ________________________,则假设2成立 ③若______________________________ ______________________,则假设3成立 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
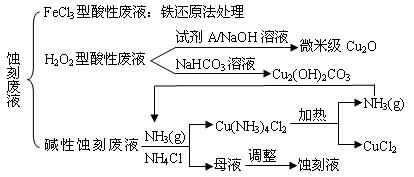
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
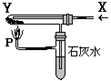
| A.H2和NaHCO3(白) | B.CO2和Na2O2(黄); |
| C.CO和Cu2(OH)2CO3(绿) | D.CO和Fe2O3(红); |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
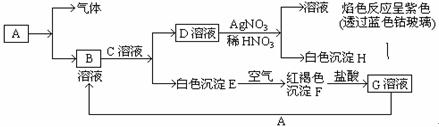
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.①②④ | C.①②③ | D.②③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com