
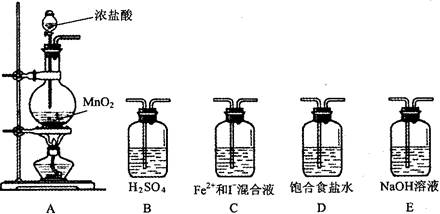
| ʵ�鲽�� | Ԥ������ͽ��� |
| ȡ������Ӧ��Ļ����Һ������A��B���Թ��У� ��A�еμ�__________��Һ ��B�еμ�__________��Һ | ����_______________________________ ________________________�������1���� ����____________________________ ________________________�������2���� ����______________________________ ______________________�������3���� |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

A���ڿ����м��� | B������������ˮ����ֽ������� | C������������NaOH��Һ����ַ�Ӧ����� | D���������������ᣬ��ַ�Ӧ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������KSCN | B��ͨ������ | C���������� | D������ͭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 a2Fe2O4+ NH3+ NaOH
a2Fe2O4+ NH3+ NaOH Fe3O4+4NaOH
Fe3O4+4NaOH ������1mol Na2Fe2O4���ɣ���Ӧ����____________mol����ת�ơ�
������1mol Na2Fe2O4���ɣ���Ӧ����____________mol����ת�ơ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ȡ15.2g����ͭ���壬����1000 mLˮ |
B����ȡ2 4g��������ˮ���1000 mL��Һ 4g��������ˮ���1000 mL��Һ |
| C����ȡ16 g����ͭ���壬����1000 mLˮ |
| D����ȡ25 g��������ˮ���1000 mL��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 O������֮�ȡ�
O������֮�ȡ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����n=5.1����m��ֵ����Ϊ9.8 |
| B����n=5.1����μӷ�Ӧ����������ʵ���Ϊ0.4 mol |
| C����n=5.1��������NaOH��Һ�����Ϊ150 mL |
D����n =5.1����ԭ����������ʵ���Ϊ0.1 mol =5.1����ԭ����������ʵ���Ϊ0.1 mol |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com