
| A.称取15.2g硫酸铜固体,加入1000 mL水 |
B.称取2 4g胆矾溶于水配成1000 mL溶液 4g胆矾溶于水配成1000 mL溶液 |
| C.称取16 g硫酸铜固体,加入1000 mL水 |
| D.称取25 g胆矾溶于水配成1000 mL溶液 |
科目:高中化学 来源:不详 题型:单选题
| A.0.1 mo/L | B.1 mo/L | C.0.08 mo/L | D.0.8 mo/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应后生成的盐只为Fe(NO3)3 |
| B.反应后生成的盐只为Fe(NO3)2 |
| C.反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为1∶3 |
| D.反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为3∶1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
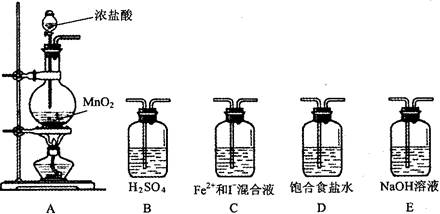
| 实验步骤 | 预期现象和结论 |
| 取少量反应后的混合溶液分置于A、B两试管中; 往A中滴加__________溶液 往B中滴加__________溶液 | ①若_______________________________ ________________________,则假设1成立 ②若____________________________ ________________________,则假设2成立 ③若______________________________ ______________________,则假设3成立 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
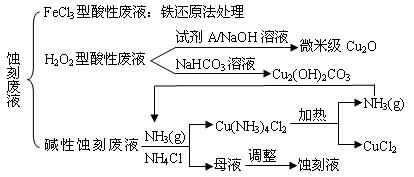
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
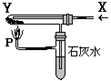
| A.H2和NaHCO3(白) | B.CO2和Na2O2(黄); |
| C.CO和Cu2(OH)2CO3(绿) | D.CO和Fe2O3(红); |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
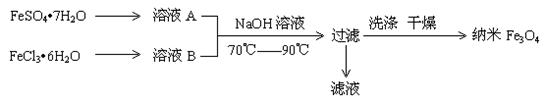
 O 和 FeCl3·6H2O的物质的量之比最好应为 ,在此条件下,检验铁元素是否沉淀完全的实验操作是 。
O 和 FeCl3·6H2O的物质的量之比最好应为 ,在此条件下,检验铁元素是否沉淀完全的实验操作是 。| A.纳米Fe3O4磁硫体分散系属于溶液。 |
B.纳米Fe3O4磁硫体可 以通过渗析法得到提纯。 以通过渗析法得到提纯。 |
| C.当一束可见光通过该磁硫体时会出现光亮的通路。 |
| D.纳米Fe3O4磁硫体比较稳定。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1∶7 | B.2∶1 | C.2∶7 | D.7∶2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com