
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.10 | 0.20 | 0.20 |
| c(CO2)/mol/L | 0.10 | 0.10 | 0.20 |
| A、平衡时,乙中CO2的转化率大于50% | ||
| B、当反应平衡时,丙中c(CO2)是甲中的2倍 | ||
C、温度升至800℃,上述反应平衡常数为
| ||
| D、其他条件不变,若起始时向容器乙中充入0.10mol/L H2和0.20 mol/L CO2,到达平衡时c (CO)与乙不同 |
| 0.05mol/L |
| 0.10mol/L |
| 0.05×0.05 |
| 0.05×0.05 |
| 25 |
| 16 |
| x2 |
| (0.1-x)(0.2-x) |
| 0.2 |
| 3 |
| y2 |
| (0.2-y)(0.1-y) |
| 0.2 |
| 3 |


科目:高中化学 来源: 题型:
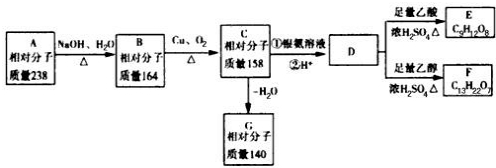 A、B、C、D、E、F、G都是链状有机物,它们的转化关系如图所示,A只含一种官能团,D的相对分子质量与E相差42,D的核磁共振氢谱图上有3个峰,且峰面积之比为1:3:6,请回答下列问题;
A、B、C、D、E、F、G都是链状有机物,它们的转化关系如图所示,A只含一种官能团,D的相对分子质量与E相差42,D的核磁共振氢谱图上有3个峰,且峰面积之比为1:3:6,请回答下列问题;查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(H2)=v(N2)=v(NH3) |
| B、v(N2)=2v(NH3) |
| C、2v(H2)=3v(NH3) |
| D、v(N2)=3v(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、都正确 | B、②④⑤⑥ |
| C、②⑤⑥ | D、④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
| B、I2+SO2+2H2O=4H++SO42-+2I- |
| C、2Fe2++Cl2=2Fe3++2Cl- |
| D、2Br-+4H++SO42-=SO2+Br2+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com