
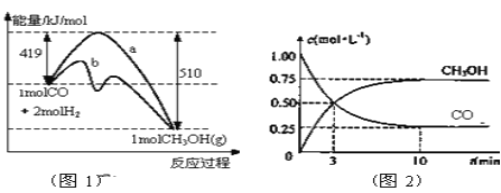
【题目】工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g) ![]() CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
请回答下列问题
(1)在“图1”中,曲线______(填a或b)表示使用了催化剂;该反应属于_____________(填吸热、放热)反应。
(2)从反应开始到建立平衡, v(H2)=________;反应达到化学平衡时,下列有关叙述正确的是______ 。
a.容器内气体压强保持不变
b.反应放热182 kJ
c.若升温,该反应的v(正)增大,v(逆)减小
d.若向容器内通入少量氢气,则此时v(正)>v(逆)
(3)甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:2CH3OH(l)+ 3O2(g)==2CO2(g)+4 H2O(l)。其工作原理示意图如下:
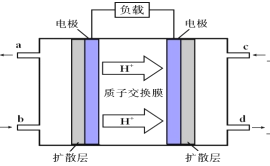
①上图的出入口通入或排出的物质名称(或化学式)b________ ,a_____________.
②负极的电极反应式为_____________________________________。电池中放电过程中负极附近溶液的pH将_____________(填“下降”、“上升”或“不变”);
(4)最近,又有科学家制造出一种固体电解质的燃料电池,其效率更高。一个电极通入空气,另一个电极通入汽油蒸气。其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-离子(其中氧化反应发生完全)。以丁烷代表汽油。该电池的正极反应式___________________________。该电池的负极反应式__________________________________。放电时固体电解质里的O2-离子的移动方向是向_________________极移动(填“正”或“负”)。
【答案】 b 放热 0.15 mol/L.min-1 ad CH3OH CO2 CH3OH-6e-+H2O=CO2+6H+ 下降 O2+4e-=2O2- C4H10-26e-+13O2-=4CO2+5H2O 负
【解析】(1)催化剂降低反应的活化能,则在“图1”中,曲线b表示使用了催化剂;反应物总能量高于生成物总能量,该反应属于放热反应。(2)从反应开始到建立平衡,生成甲醇是0.75mol/L,根据方程式可知消耗氢气是1.5mol/L,则v(H2)=1.5mol/L÷10min=0.15 mol/L·min-1;a.正反应体积减小,反应达到化学平衡时,容器内气体压强保持不变,a正确;b.生成甲醇是0.75mol/L,物质的量是1.5mol,所以反应放热1.5×(510kJ-419kJ)=136.5kJ,b错误;c.若升温,正逆反应速率均增大,c错误;d.若向容器内通入少量氢气,反应物浓度增大,平衡向正反应方向进行,则此时v(正)>v(逆),d正确,答案选ad;
(3)①原电池中阳离子向正极移动,则根据图中氢离子的移动方向可知右侧电极是正极,左侧是负极,因此b处通入的是甲醇,甲醇的氧化产物是CO2,则a处流出的是CO2;②甲醇在负极通入,负极的电极反应式为 CH3OH-6e-+H2O=CO2+6H+。根据负极电极反应式可知负极产生氢离子,则电池中放电过程中负极附近溶液的pH将下降;(4)氧气在正极通入,由于传递的是氧离子,则该电池的正极反应式为O2+4e-=2O2-。汽油在负极通入,该电池的负极反应式为C4H10-26e-+13O2-=4CO2+5H2O。原电池中阴离子向负极移动,则放电时固体电解质里的O2-离子的移动方向是向负极移动。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】以铬铁矿为原料制备铬酸钾(K2Cr2O7)的工艺流程如下图所示。铬铁矿的主要成分可表示为FeO-Cr2O3和杂质SiO2。
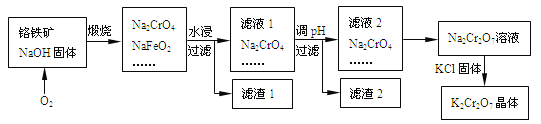
已知:①NaFeO2遇水强烈水解
②2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
回答下列问题:
(1)K2CrO4中Cr元素的化合价是________。
(2)完成并配平煅烧铬铁矿生成Na2CrO4和NaFeO2的化学反应方程式________
FeO-Cr2O3+ O2+ NaOH![]() Na2CrO4+NaFeO2+ ;
Na2CrO4+NaFeO2+ ;
该反应的氧化产物是________。
(3)生成滤渣1中红褐色物质的化学反应方程式是____________。滤渣2的成分(填化学式)_______。
(4)滤液2存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O。若改变条件使上述平衡向正方向移动,则下列说法正确的是______。
Cr2O72-(橙色)+H2O。若改变条件使上述平衡向正方向移动,则下列说法正确的是______。
A.达到新平衡后,溶液PH一定增大
B.再达到新平衡前,正反应速率一定大于逆反应速率
C.该反应平衡常数可以不改变
D.达新平衡后,CrO42-的消耗速率等于Cr2O72-的消耗速率
(5)含铬废水中含有一定量的Cr2O72-和CrO42-,它们会对人体及生态系统产生很大的危害,必须进行处理。还原沉淀法是常用的一种方法:
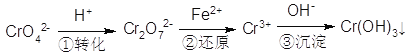
①上述流程中还原过程的离子反应方程式为:_______________。
②最终生成的Cr(OH)3在溶液中存在沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH—(aq)常温下,Cr(OH)3的Ksp=1×10-32,当c(Cr3+)降至1×10-3·mol·L-1,溶液的pH应调至4时______(填“有”或“没有”)沉淀生成。
Cr3+(aq)+3OH—(aq)常温下,Cr(OH)3的Ksp=1×10-32,当c(Cr3+)降至1×10-3·mol·L-1,溶液的pH应调至4时______(填“有”或“没有”)沉淀生成。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用同一原理解释的是:
A. SO2和Cl2都能用于漂白
B. I2、NH4Cl晶体受热都逐渐消失
C. 配制Fe(NO3)3和Sn(NO3)2溶液均要加入稀硝酸
D. SO2可使加酚酞的氢氧化钠溶液和酸性高锰酸钾溶液的红色都褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸性燃料电池(以甲醇为燃料,酸性介质)结构示意如图。下列有关说法正确的是
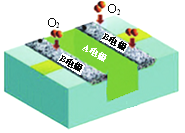
A. 电池工作时,电子由A电极经外电路流向B电极
B. 电池工作时,减少的化学能完全转化为电能
C. A电极发生的电极反应为:CH3OH-6e-+H2O=CO2+6H+
D. B电极每消耗1 mol O2,电池中减少4 mol H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
①在热化学方程式中无论是反应物还是生成物都必须标明状态 ②所有的化学反应都伴随着能量变化 ③放热反应发生时不必加热 ④吸热反应在加热后才能发生 ⑤化学反应的热效应数值只与参加反应的物质的多少有关 ⑥一般来说,吸热反应在一定条件下也能发生 ⑦依据盖斯定律,反应焓变的大小与反应的途径有关
A.②③⑥⑦ B.③④⑤⑦ C.④⑤⑦ D.③④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活、环境保护等密切相关。下列做法不正确的是
A. 推广使用电动汽车低碳交通工具
B. 用CO2合成可降解的聚碳酸酯塑料
C. 用生物方法脱除生活污水中的氮和磷
D. 加大铅酸蓄电池、含汞锌锰等电池的生产
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W 4种元素分别是元素周期表中3个连续短周期的元素且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子的最外层电子数之和。Y与X形成的分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)写出Z在周期表中的位置______________。W离子的结构示意图:_______________________。
(2)由以上元素中两两形成的化合物中,溶于水显碱性的气态氢化物的结构式为:__________________。
既含离子键又含非极性共价键的化合物的电子式为________;既含极性共价键又含非极性共价键的化合物的电子式为________。
(3)Z的氢化物熔沸点在其同主族氢化物中熔沸点最高,原因是_______________________。
(4)用化学方程式表示Z与其同主族短周期元素的非金属性强弱___________________________ 。
(5)由X、Y、Z所形成的常见离子化合物是________(写化学式),该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为____________________;X与W形成的化合物与水反应时,水作________ (填“氧化剂”或“还原剂”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室进行下列实验,括号内的实验仪器或试剂都能用到的是
A.铝热反应(铝热剂、镁带、氯酸钾、蒸发皿)
B.钠的焰色反应(氯化钠溶液、盐酸、铂丝、蓝色钴玻璃)
C.中和热的测定(量筒、温度计、环形玻璃搅拌棒、酒精灯)
D.制取氢氧化铁胶体(饱和FeCl3溶液、NaOH溶液、烧杯、胶头滴管)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应①X(g)+2Y(g) ![]() 2Z(g) 、②2M(g)
2Z(g) 、②2M(g)![]() N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
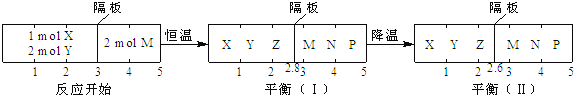
下列判断正确的是
A.反应①的正反应是吸热反应
B.达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15
C.达平衡(I)时,X的转化率为![]()
D.在平衡(I)和平衡(II)中M的体积分数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com