
【题目】铜片和锌片用导线连接后插入稀硫酸中,电解质溶液的pH将( )
A.不变
B.先变小后边大
C.逐渐变大
D.逐渐变小
科目:高中化学 来源: 题型:
【题目】将5.10g镁铝合金加入120mL4.0mol·L-1的盐酸中,待合金完全溶解后,得到溶液X。下列说法一定正确的是
A. 合金完全溶解后产生的H2的物质的量为0.24mol
B. 合金中的镁与铝的物质的量之比小于1
C. 若向溶液X中加入270mL2.0mol·L-1NaOH溶液,充分反应,所得沉淀为Mg(OH)2
D. 若向溶液X中加入足量的氨水,充分反应,所得沉淀经过过滤、洗涤后充分灼烧,则残留固体质量大于8.50g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92.4kJ·mol-1。一种工业合成氨的简式流程图如下:
2NH3(g)ΔH=-92.4kJ·mol-1。一种工业合成氨的简式流程图如下:
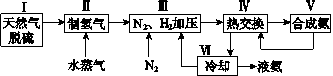
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:_______________________。
(2)步骤Ⅱ中制氢气的原理如下:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g)△H=+206.4kJ·mol-1
CO(g)+3H2(g)△H=+206.4kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=-41.2kJ·mol-1
CO2(g)+H2(g)△H=-41.2kJ·mol-1
对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是____________。
a.升高温度b.增大水蒸气浓度c.加入催化剂d.降低压强
利用反应②,将CO进一步转化,可提高H2的产量。若1molCO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO的转化率为__________。
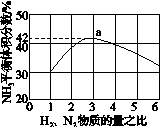
(3)图(a)表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:____________。
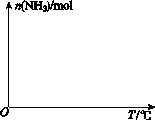
(4)依据温度对合成氨反应的影响,在图(b)坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
(a)(b)
(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。简述本流程中提高合成氨原料总转化率的方法:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把100 mL含有CaCl2和KCl的混合溶液分成2等份,取一份加入含amol碳酸钠的溶液,恰好使钙离子完全沉淀;另取一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
A. 20(b-2a) mol/L B. 10(2a-b) mol/L
C. 20(b-a) mol/L D. 0.1(b-2a) mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生产钛白的副产品绿矾(FeSO47H2O)制备还原铁粉的步骤如下:将绿矾溶于稀硫酸溶液,向其中滴加(NH4)2CO3溶液,得到FeCO3nH2O沉淀,静置,过滤,洗涤,干燥,再将FeCO3与煤粉一起焙烧,最终制得还原铁粉。涉及的主要反应有:
FeCO3![]() FeO+CO2,
FeO+CO2,
C+CO2![]() 2CO,
2CO,
CO+FeO![]() Fe+CO2,
Fe+CO2,
(1)检验绿矾是否已有部分氧化的方法是 。
(2)证明沉淀已经洗涤干净的方法是 。
(3)干燥过程中少量FeCO3nH2O被氧化为FeOOH,反应方程式为: 。
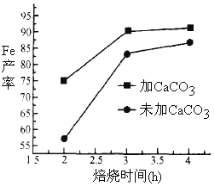
(4)实际生产中,所得沉淀仍含少量硫酸盐,在焙烧过程中需加入CaCO3进行脱硫处理,上图为加CaCO3和不加CaCO3对还原铁粉的产率的影响,根据图像分析,CaCO3的另一作用为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中能大量共存的是 ( )
A.K+、HCO3-、CO32-、Br- B.SO32-、HSO3-、OH-、K+
C.Fe3+、Cu2+、NO3-、SO32- D.H+、Na+、NO3-、Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类生存和发展的重要支柱。研究并有效地开发新能源在能源紧缺的今天具有重要的理论意义。已知H2与CO反应生成CH3OH的过程如图所示:
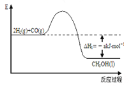
CO的燃烧热△H2=-bkJ·mol-1,CH3OH的燃烧热
△H3=-ckJ·mol-1。请根据以上信息,回答下列有关问题:
(1)甲醇是一种(填“可”或“不可”)再生能源,甲醇的官能团的电子式是 。
(2)CH3OH燃烧的热化学反应方程式为。
(3)H2的燃烧热△H=。
(4)一些化学键键能如下:C≡O为dkJ/mol;O=O为ekJ/mol;C=O为fkJ/mol。则由以上数据有b=
(用d、e、f的代数式表示)。
(5)H2和CO的混合气体nmol,充分燃烧共放出QkJ热量,则混合气体中H2和CO的物质的量之比为。
(6)CO与O2可以组成新型燃料电池,若该电池以Pt为电极,以KOH为电解质溶液,写出该燃料电池的正极反应式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com