
��8�֣�����P(s)��Cl2(g)������Ӧ����PCl3(g)��PCl5(g)����Ӧ���̺�������ϵ��ͼ��ʾ(ͼ�еĦ�H��ʾ����1 mol���������)������ͼ�ش��������⣺
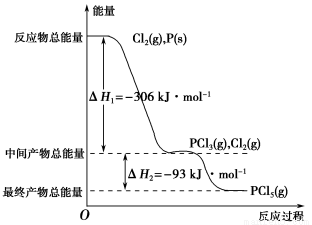
��1��P��Cl2��Ӧ����PCl3���Ȼ�ѧ����ʽ�� ��
��2��PCl5�ֽ��PCl3��Cl2���Ȼ�ѧ����ʽ�� ��
��3��P��Cl2��������Ӧ����1 mol PCl5�Ħ�H3��____________��P��Cl2һ����Ӧ����1mol PCl5�Ħ�H4____��H3(����ڡ���С�ڡ����ڡ�)��
 �����ҵ���������ͯ������ϵ�д�
�����ҵ���������ͯ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016������ʡ������ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
һ���¶��£���NaOH��Һ�м���һ�������ƿ飬��ַ�Ӧ��ָ���ԭ���¶ȣ�����˵����ȷ����
A����Һ�������������ӣ��ܼ��������٣���Һ�����ʵ������������
B����Һ��pH���䣬�������ų�
C����Һ�е�Na����Ŀ��С���������ų�
D����Һ�е�c(Na��)�����������ų�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ��ˮ�и����ϵ�һ�μ�⿼�Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���и�����������ָ�������д����������
A����c��HCO3-��=0.1 mol/L����Һ�У�NH4+��AlO2-��Cl-��NO3-
B������ˮ�������c��H+��=1��10-12 mol/L����Һ�У�Fe2+��ClO-��Na+��SO42-
C���ڼ������۲���H2����Һ�У�SO42-��NO3-��Na+��NH4+
D����ʹ��ɫʯ����ֽ��������Һ�У�SO32-��CO32-��Na+��K+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ɽ����Ȫʮ���и�����һ�νο��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��һ��������Һ�п��ܴ���Fe3+��NO3-��Cl-��I-�е�һ�ֻ������ӣ�����Һ�м�����ˮ���嵥�ʱ���ԭ���ɴ˿��ƶ���Һ��
A��һ������I-�����ܺ���Cl-
B�����ܺ���Cl-��NO3-��I-
C�����ܺ���NO3-
D��������Fe3+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ����Ͽ�и߶���ѧ����ѧ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪��2H2(g)��O2(g)��2H2O(l) ��H����571��6 kJ��mol��1
2CH3OH(l)��3O2(g)��2CO2(g)��4H2O(l) ��H����1452 kJ��mol��1
H��(aq)��OH��(aq)��H2O(l) ��H����57��3 kJ��mol��1
����˵����ȷ����
A��H2(g)��ȼ����Ϊ -571��6 kJ��mol��1
B��ͬ������H2(g)��CH3OH(l)��ȫȼ�գ�H2(g)�ų���������
C��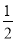 H2SO4(aq)��
H2SO4(aq)��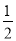 Ba(OH)2(aq)��
Ba(OH)2(aq)�� 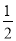 BaSO4(s)��H2O(l) ��H����57��3 kJ��mol��1
BaSO4(s)��H2O(l) ��H����57��3 kJ��mol��1
D��3H2(g)��CO2(g)�� CH3OH(l)��H2O(l) ��H����135��9 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����һ�и������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£�������Һ��pH���������ʵ���Ũ�ȹ�ϵ��ȷ����
A��ij���ʵ���Һ����ˮ�������c��H+����1��10-amol/L����a��7ʱ�������Һ��pHһ��Ϊ14��a
B��ij��Һ�д��ڵ�������S2����HS����OH����Na����H����������Ũ��һ���� c(Na��)��c(S2��)��c(OH��)��c(HS��)��c(H��)
C����0.2 mol/L��ijһԪ��HA��Һ��0.1mol/L NaOH��Һ�������Ϻ���ҺpH����7����Ӧ��Ļ��Һ��2c(OH��)��2c(H+)��c(HA)��c(A��)
D����Na2CO3��Һ ��CH3COONa��Һ��NaOH��Һ����3����ҺpH��Ϊ9�����������ʵ���Ũ�ȴ�С˳���Ǣ�>��>��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ɽ��̫ԭ���и߶��ϵ�һ�ܿ����ƻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��1200��ʱ����Ȼ���������лᷢ�����з�Ӧ
H2S��g��+ 3/2O2(g)=SO2(g)+H2O(g) ��H1
2H2S(g)+SO2(g)=3/2S2(g)+2H2O(g) ��H2
H2S(g)+1/2O2(g)=S(g)+H2O(g) ��H3 2S(g) =S2(g) ��H4
���H4����ȷ����ʽΪ
A����H4=2/3����H1+��H2-3��H3�� B����H4=2/3��3��H3-��H1-��H2��
C����H4=3/2����H1+��H2-3��H3�� D����H4= 3/2����H1-��H2-3��H3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꼪��ʡ��һ9�¼�⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
��pH=1����Һ�У����Դ��������������
A��K + ��Na + ��SO42����SO32�� B��NH4����Mg 2+ ��SO42����Cl -
C��Na + ��K + ��HCO3����Cl - D��K + ��Na + �� NO3����CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��㶫ʡ����У������һ��������ѧ�Ծ��������棩 ���ͣ�ѡ����
������(��ͼ)��������������ҩ����Ұ���ܲ�����Ҷˮ�ա�������С���������ֹѪ���á����й��ڿ������˵������ȷ����
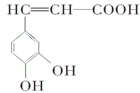
A��������ķ���ʽΪC9H8O4
B��1 mol��������Ժͺ�4 molBr2��Ũ��ˮ��Ӧ
C��1 mol��������Ժ�3 mol NaOH��Ӧ
D�������ø�����ؼ��������������к���̼̼˫��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com