
一定温度下,向饱和NaOH溶液中加入一定量的钠块,充分反应后恢复到原来温度,下列说法正确的是
A.溶液中溶质质量增加,溶剂质量减少,溶液中溶质的质量分数变大
B.溶液的pH不变,有氢气放出
C.溶液中的Na+数目减小,有氧气放出
D.溶液中的c(Na+)增大,有氢气放出
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016届河北省高三9月月考化学试卷(解析版) 题型:选择题
关于氧化钠和过氧化钠的叙述正确的是
A.都属于碱性氧化物 B.溶于水后,所得水溶液的成分相同
C.都能和水发生化合反应 D.都可和二氧化碳反应生成不同的盐
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省邯郸市高二上第一次月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.HCl溶液中无OH-
B.NaOH溶液中无H+
C.NaCl溶液中既无OH-,也无H+
D.常温下,任何物质的稀溶液中都有H+和OH-,且Kw=c(H+)·c(OH-)=10-14
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期第一次模拟考试化学试卷(解析版) 题型:填空题
(8分)丙烯是重要的化工原料,一定条件下可发生下列转化:

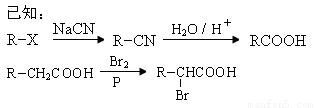
回答下列问题:
(1)以下化合物中含有羧基的是 。
A.化合物B B.化合物C C.化合物D D.化合物E
(2)上述反应中未涉及的反应类型是 。
A.取代反应 B.加成反应 C.还原反应 D.加聚反应
(3)写出含碳数最少且与D互为同系物的有机物的结构简式___________;写出D与足量乙醇发生反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2016届云南省高三上学期第一次月考化学试卷(解析版) 题型:填空题
(14分)常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-,已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题。
(1)五种盐中,一定没有的阳离子是 ;所含阴离子相同的两种盐的化学式是 。
(2)D的化学式为 ,D溶液显碱性的原因是(用离子方程式表示) 。
(3)A和C的溶液反应的离子方程式是 ;E和氨水反应的离子方程式是 。
(4)若要检验B中所含的阳离子,正确的实验方法是 。
查看答案和解析>>
科目:高中化学 来源:2016届山东省齐鲁教科研协作体19所高三上学期第一次联考化学试卷(解析版) 题型:填空题
(6分)T℃时,向体积为2L的恒容密闭容器中充入4molA和2molB气体,发生如下反应:4A(g)+B(g)  xC(g),保持温度不变,5min时反应达到平衡状态,剩余1.6 molB,并测得C的浓度为0.8mol/L,请填写下列空白:
xC(g),保持温度不变,5min时反应达到平衡状态,剩余1.6 molB,并测得C的浓度为0.8mol/L,请填写下列空白:
(1)x=__________,该反应平衡常数的表达式为:K= 。
(2)该温度下,此反应达到平衡时,A的转化率为α(A)= 。
(3)在T℃时,若向原平衡混合物的容器中再充入amolC,同时改变容器体积保持压强不变,欲使达到新的平衡时,各物质的体积分数与原平衡相同,则应再充入________molB (用a表示)。
查看答案和解析>>
科目:高中化学 来源:2016届山东省齐鲁教科研协作体19所高三上学期第一次联考化学试卷(解析版) 题型:选择题
当我们查看葡萄酒标签上的成分信息时,常发现其成分中含有少量SO2。下列关于SO2说法正确的是
A.SO2属于非法添加剂,不该添加到葡萄酒中
B.SO2具有还原性,少量的SO2可防止葡萄酒氧化变质
C.SO2具有还原性,不能用浓硫酸干燥
D.SO2可以使酸性KMnO4溶液褪色,体现了它的漂白性
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省张掖市高三上学期第一次质量检测化学试卷(解析版) 题型:填空题
煤化工中两个重要反应为①C(s)+H2O(g)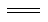 H2(g)+CO(g) ΔH=+131.3 kJ·mol-1,②CO(g)+ H2O(g)
H2(g)+CO(g) ΔH=+131.3 kJ·mol-1,②CO(g)+ H2O(g) CO2(g) + H2(g)。
CO2(g) + H2(g)。
(1)下列说法正确的是 。
A.当反应①的容器中混合气体的密度不再变化时反应达到最大限度
B.反应②的熵变△S >0
C.反应①中增加C固体的量能增大反应速率
D.在反应中②及时分离出产生的H2对正反应速率无影响
(2)若工业上要增加反应①的速率,最经济的措施为 。
(3)现将不同量的CO(g)和H2O(g)分别通入2L恒容密闭容器中进行反应,得到如下三组数据:
实验组] | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/ min | ||
CO | H2O | H2 | CO2 | |||
I | 650 | 4 | 2 | 1.6 | 1.6 | 5 |
Ⅱ | 900 | 2 | 1 | 0.5 | 0.5 | 3 |
Ⅲ | 900 | a | b | c | d | t |
①实验I中,从反应开始到反应达到平衡时,H2O的平均反应速率为___。
②CO(g)和H2O(g)反应的△H 0(填“大于”、“小于”或“等于”)
③实验III中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是_____,与实验Ⅱ相比,化学平衡常数 (填“增大”、“减小”或“不变”)。
④若在900℃时,实验II反应达到平衡后,向此容器中再加入1 mol CO、0.5 mol H2O、0.2 mol CO2、0.5 mol H2,平衡向________方向移动(填“正反应”、“逆反应”“不移动”)。
(4)CO、H2可用于甲醇和甲醚,其反应为(m、n均大于0):
反应①:CO(g)+2H2(g) CH3OH(g) ΔH= -mkJ·mol-1
CH3OH(g) ΔH= -mkJ·mol-1
反应②: 2CO(g)+4 H2(g) CH3OCH3(g) +H2O(g) ΔH=-nkJ·mol-1
CH3OCH3(g) +H2O(g) ΔH=-nkJ·mol-1
反应③:2CH3OH(g) CH3OCH3(g)+ H2O(g) △H<0
CH3OCH3(g)+ H2O(g) △H<0
则m与n的关系为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上学期第一次月考化学试卷(解析版) 题型:填空题
(8分)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的ΔH表示生成1 mol产物的数据)。根据图回答下列问题:
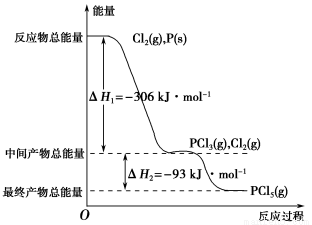
(1)P和Cl2反应生成PCl3的热化学方程式是 。
(2)PCl5分解成PCl3和Cl2的热化学方程式是 。
(3)P和Cl2分两步反应生成1 mol PCl5的ΔH3=____________,P和Cl2一步反应生成1mol PCl5的ΔH4____ΔH3(填“大于”“小于”或“等于”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com