
(6分)T℃时,向体积为2L的恒容密闭容器中充入4molA和2molB气体,发生如下反应:4A(g)+B(g)  xC(g),保持温度不变,5min时反应达到平衡状态,剩余1.6 molB,并测得C的浓度为0.8mol/L,请填写下列空白:
xC(g),保持温度不变,5min时反应达到平衡状态,剩余1.6 molB,并测得C的浓度为0.8mol/L,请填写下列空白:
(1)x=__________,该反应平衡常数的表达式为:K= 。
(2)该温度下,此反应达到平衡时,A的转化率为α(A)= 。
(3)在T℃时,若向原平衡混合物的容器中再充入amolC,同时改变容器体积保持压强不变,欲使达到新的平衡时,各物质的体积分数与原平衡相同,则应再充入________molB (用a表示)。
 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源:2016届河北省高三9月月考化学试卷(解析版) 题型:选择题
钠在干燥空气中形成的氧化物0.70 g,溶于水后,可被100 g质量分数为0.73%的盐酸恰好中和,钠的氧化物的成分是
A.Na2O2和Na2O B.Na2O C.Na2O2 D.无法确定
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北大名县第一中学高二上学期第一次月考试化学试卷(解析版) 题型:选择题
在一定温度下的定容密闭容器中,下列情况能表明可逆反应:H2(g)+I2(g)  2HI(g)已达平衡的是
2HI(g)已达平衡的是
A.H2的生成速率与I2的生成速率相等
B.若单位时间内生成n mol H2的同时生成2n mol HI
C.H2、I2、HI的浓度相等
D.反应容器内的压强不随时间的变化而变化
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期第一次模拟考试化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列叙述一定正确的是
A.1 L 2 mol·L-1的NH4Cl溶液中含有的NH4+数目为2NA
B.标况下,0.1mol苯中含有C=C键数目为0.3NA
C.常温常压下,5.2g乙炔和苯的混合气体中含有的碳原子数为0.4NA
D.7.8g过氧化钠与足量CO2反应,转移电子数为0.2NA,CO2为还原剂
查看答案和解析>>
科目:高中化学 来源:2016届云南省高三上学期第一次月考化学试卷(解析版) 题型:选择题
一定温度下,向饱和NaOH溶液中加入一定量的钠块,充分反应后恢复到原来温度,下列说法正确的是
A.溶液中溶质质量增加,溶剂质量减少,溶液中溶质的质量分数变大
B.溶液的pH不变,有氢气放出
C.溶液中的Na+数目减小,有氧气放出
D.溶液中的c(Na+)增大,有氢气放出
查看答案和解析>>
科目:高中化学 来源:2016届山东省齐鲁教科研协作体19所高三上学期第一次联考化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.向KAl(SO4)2溶液中滴加Ba(OH)2溶液至Al3+恰好沉淀完全:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
B.向NH4HSO4溶液中滴加过量NaOH溶液并加热:NH4++OH- H2O+NH3↑
H2O+NH3↑
C.向AlCl3溶液中滴加过量氨水:Al3++4NH3?H2O=[Al(OH)4]-+4NH4+
D.FeO溶于稀硝酸中:FeO+2H+=Fe2++H2O
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省天水市高三上第一次检测考试化学试卷(解析版) 题型:实验题
(15分)高铁酸钾(K2FeO4)是一种集氧化、吸附、速凝于一体的新型多功能水处理剂。其生产流程如下:
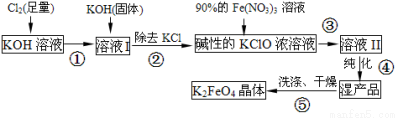
(1)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度是 mol/L。
(2)在溶液I中加入KOH固体的目的是 (填编号)。
A.与溶液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使副产物KClO3转化为 KClO
(3)每制得59.4克K2FeO4,理论上消耗氧化剂的物质的量为 mol。从溶液Ⅱ中分离出K2FeO4后,还得到副产品KNO3、KCl,写出③中反应的离子方程式: 。
(4)高铁酸钾(K2FeO4)溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生,该反应的离子方程式是 。
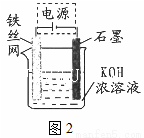
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图2所示。电解过程中阳极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2016届天津一中高三零月考化学试卷(解析版) 题型:选择题
常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是
A.某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14-a
B.某溶液中存在的离子有S2-、HS-、OH-、Na+、H+,则离子浓度一定是 c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
C.将0.2 mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:2c(OH-)=2c(H+)+c(HA)-c(A-)
D.①Na2CO3溶液 ②CH3COONa溶液③NaOH溶液,若3种溶液pH均为9,则它们物质的量浓度大小顺序是①>②>③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com