
【题目】从铝土矿(主要成分为Al2O3,还有少量杂质)中提取铝的工艺流程及步骤如下:
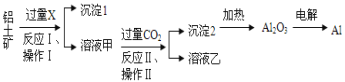
试回答下列问题:
(1)试剂X为__________;
(2)写出试剂X溶解Al2O3的化学方程式________
(3)操作Ⅰ、操作Ⅱ均为_________(填操作名称);
(4)金属铝与氧化铁混合在高温下,会发生剧烈的反应,该反应的化学方程式为_______;
(5)反应Ⅱ的离子方程式为______;
(6)电解熔融氧化铝制取金属铝,若有0.6 mol电子发生转移,理论上能得到金属铝的质量是________g。
【答案】NaOH溶液 2NaOH+ Al2O3 = 2NaAlO2 + H2O 过滤 Al+Fe2O3![]() Al2O3+2Fe CO2+AlO2+2H2O=Al(OH)3↓+HCO3 4.05
Al2O3+2Fe CO2+AlO2+2H2O=Al(OH)3↓+HCO3 4.05
【解析】
铝土矿(主要成分为Al2O3,还有少量杂质)加入过量X发生反应生成沉淀1和溶液甲,溶液甲通入过量二氧化碳生成沉淀2为氢氧化铝,加热分解生成氧化铝,电解生成铝,判断过量试剂X为氢氧化钠溶液,操作Ⅰ为分离固体和溶液的过滤操作,通入过量二氧化碳过滤得到溶液乙主要为碳酸氢钠,
(1) 分析可知试剂X为氢氧化钠溶液;
(2) X为氢氧化钠溶液,与Al2O3反应生成偏铝酸钠和水;
(3)操作Ⅰ、操作Ⅱ都是分离固体和溶液的实验操作为过滤,结合过滤装置选择玻璃仪器;
(4)金属铝与氧化铁混合在高温下,会发生剧烈的反应,生成铁和氧化铝,反应放热可以焊接钢轨;
(5)反应Ⅱ是偏铝酸钠溶液中通入过量二氧化碳生成氢氧化铝沉淀和碳酸氢钠;
(6)依据电极氧化铝的方程式中定量关系计算.
(1)分析可知试剂X为NaOH溶液,
故答案为:NaOH溶液;
(2)X为氢氧化钠溶液,与Al2O3反应生成偏铝酸钠和水,反应的化学方程式是:2NaOH+ Al2O3 = 2NaAlO2 + H2O ,
故答案为:2NaOH+ Al2O3 = 2NaAlO2 + H2O;
(3)操作Ⅰ、操作Ⅱ都是分离固体和溶液的实验操作为过滤,在实验室进行该操作时需要的玻璃仪器有漏斗、烧杯、玻璃棒,
故答案为:过滤;
(4)金属铝与氧化铁混合在高温下,会发生剧烈的反应,生成铁和氧化铝,反应的化学方程式为:2Al+Fe2O3![]() Al2O3+2Fe,反应放热可以焊接钢轨,
Al2O3+2Fe,反应放热可以焊接钢轨,
故答案为:Al+Fe2O3![]() Al2O3+2Fe;
Al2O3+2Fe;
(5)反应Ⅱ是偏铝酸钠溶液中通入过量二氧化碳生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式:CO2+AlO2+2H2O=Al(OH)3↓+HCO3,
故答案为:CO2+AlO2+2H2O=Al(OH)3↓+HCO3;
(5)电解熔融氧化铝制取金属铝,2 Al2O3![]() .4Al+3O2↑,反应中电子转移12mol生成铝3mol,若有0.6mol电子发生转移,理论上能得到金属铝的物质的量是0.6mol×3mol÷12mol=0.15mol,生成铝的质量=0.15mol×27g/mol=4.05g,
.4Al+3O2↑,反应中电子转移12mol生成铝3mol,若有0.6mol电子发生转移,理论上能得到金属铝的物质的量是0.6mol×3mol÷12mol=0.15mol,生成铝的质量=0.15mol×27g/mol=4.05g,
故答案为:4.05。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】下列是化工生产重要原料甲叉琥珀酸的合成路线:

已知:R-Br+NaCN→R-CN+NaBr,R-CN![]() R-COONa+NH3↑,R-CCl3
R-COONa+NH3↑,R-CCl3![]() R-COONa+NaCl。
R-COONa+NaCl。
(1)已知A核磁共振氢谱中有两组吸收峰,且A不存在顺反异构,则A的名称为____。
(2)E的官能团名称为_____,B→C的反应类型是_____。
(3)写出下列过程的化学反应方程式:E→F:_____。
(4)写出符合下列条件的甲叉琥珀酸的同分异构体M的结构简式___。
①M可以使酸性高锰酸钾褪色
②1molM和足量的NaHCO3溶液反应,最多放出2molCO2
③核磁共振氢谱中只有三组吸收峰
(5)应用已学知识,以![]() 为原料设计合成
为原料设计合成![]() 的路线图(无机试剂任选)。____
的路线图(无机试剂任选)。____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是

A. 原子半径:W>Z>Y>X
B. 气态氢化物的稳定性:W<Z<X<Y
C. Z的最高价氧化物的水化物可能为强碱
D. W的最高正化合价与负化合价的绝对值可能相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇被称为21世纪的“绿色能源”。由于煤制乙酸工艺成熟、成本低廉,且乙酸相对乙醇有较大的价格差,因此开展乙酸加氢制乙醇的催化反应研究具有重要意义。回答下列问题:
(1)乙酸加氢制乙醇是一个复杂的反应体系,不同的反应条件会导致形成不同的产品分布,主要反应过程如下:
反应①CH3COOH(g) + H2(g)→CH3CHO(g) +H2O(g) H1
反应②CH3CHO(g) +H2(g) →CH3CH2OH(g) △H2
部分副反应如下:
反应③CH3CH2OH(g) + CH3COOH(g)→CH3COOCH2CH3(g) +H2O(g) H3
反应④CH3COOCH2CH3(g) +2H2(g) →2CH3CH2OH(g) H4
H4=___ (用H1、△H2、 H3表示)。
(2)乙酸加氢制乙醇的反应可表示为CH3COOH(g) + 2H2(g)==CH3CH2OH(g) + H2O(g) H<0,欲提高该反应中乙酸的平衡转化率,可采取的两条措施是_________。乙酸加氢生成乙酸乙酯( 副反应)的化学方程式可表示为____________.
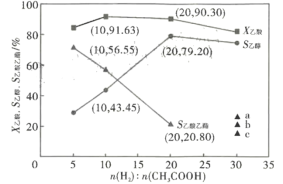
(3)在恒温2609°C, 恒压1.4MPa, 原料气以一定的流速通过某催化剂发生乙酸加氢制乙醇等反应,氢/酸(物质的量)投料比对反应的影响如图所示。X乙酸表示乙酸的转化率, S乙醇、S乙酸乙酯分别表示乙醇、乙酸乙酯的选择性,其中,S乙醇=![]() ,S乙酸乙酯=
,S乙酸乙酯=![]() 。根据图象及数据分析,最佳氢/酸投料比值是_______________,该条件下,上述反应②____________(填“能”或“不能”)进行到底,理由是____________ ;根据图中曲线变化规律,判断氢/酸投料比=30时,S乙酸乙酯曲线最可能延伸至图中a、b、c中的______点;氢/酸投料比=20时,计算H2的转化率=_______. ( 列出计算式即可,下同),乙醇的分压P乙醇=__________(分压=总压×物质的量分数)。
。根据图象及数据分析,最佳氢/酸投料比值是_______________,该条件下,上述反应②____________(填“能”或“不能”)进行到底,理由是____________ ;根据图中曲线变化规律,判断氢/酸投料比=30时,S乙酸乙酯曲线最可能延伸至图中a、b、c中的______点;氢/酸投料比=20时,计算H2的转化率=_______. ( 列出计算式即可,下同),乙醇的分压P乙醇=__________(分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,下列说法中不正确的是( )
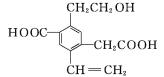
A.1 mol该有机物和过量的金属钠反应最多可以生成1.5 mol H2
B.该有机物最多消耗Na、NaOH、NaHCO3的物质的量之比为3∶2∶2
C.可以用酸性KMnO4溶液检验其中的碳碳双键
D.该有机物能够在催化剂作用下发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN,Al和N的相对原子质量分别为27和14)广泛用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C![]() 2AlN+3CO合成。下列叙述正确的是( )
2AlN+3CO合成。下列叙述正确的是( )
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1mol AlN需转移3mol电子
C.AlN中氮元素的化合价为+3
D.AlN的摩尔质量为41g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电化学的叙述,正确的是( )
A. 装置工作时两极均有气泡产生,工作一段时间后溶液的碱性增强
装置工作时两极均有气泡产生,工作一段时间后溶液的碱性增强
B.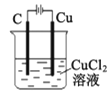 装置工作一段时间后碳极上有红色物质析出
装置工作一段时间后碳极上有红色物质析出
C.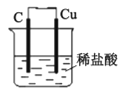 装置可以模拟金属的析氢腐蚀,铜棒一极的电极反应式为:2H++ 2e-=H2↑
装置可以模拟金属的析氢腐蚀,铜棒一极的电极反应式为:2H++ 2e-=H2↑
D.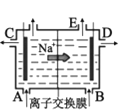 是阳离子交换膜法电解饱和食盐水原理示意图,E出口有黄绿色气体放出
是阳离子交换膜法电解饱和食盐水原理示意图,E出口有黄绿色气体放出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作与预期实验目的或所得实验结论一致的是
选项 | 实验操作和现象 | 预期实验目的或结论 |
A | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡:I3- |
B | 向1 mL浓度均为0.05 mol·L-l NaCl、NaI的混合溶液中滴加2滴0.01 mol·L-l AgNO3溶液,振荡,沉淀呈黄色 | Ksp(AgCl)<Ksp(AgI) |
C | 室温下,用 pH 试纸分别测定浓度为 0.1mol/L NaClO溶液和0.1mol/L CH3COONa溶液的pH | 比较HC1O和CH3COOH的酸性强弱 |
D | 浓硫酸与乙醇180℃共热,制得的气体通入酸性KMnO4 溶液,溶液紫色褪去 | 制得的气体为乙烯 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香料甲和G都在生活中有很多用途,其合成路线如下:

已知:①R1—CHO+R2—CH2—CHO![]()
![]() (R1、R2代表烃基或氢原子)
(R1、R2代表烃基或氢原子)
②D与A互为同系物;在相同条件下,D蒸气相对于氢气的密度为39。
(1)A的名称是____,G中含氧官能团的名称是____。
(2)②的反应类型是____,B和F的结构简式分别为______、______。
(3)写出一种能鉴别A和D的试剂:______;C有多种同分异构体,其中属于芳香族化合物的有____种。
(4)写出反应①的化学方程式:_____________。
(5)G的同分异构体 是一种重要的药物中间体,其合成路线与G相似,请以
是一种重要的药物中间体,其合成路线与G相似,请以![]() 为原料设计它的合成路线(其他所需原料自选)_________。
为原料设计它的合成路线(其他所需原料自选)_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com