
【题目】下列有关电化学的叙述,正确的是( )
A. 装置工作时两极均有气泡产生,工作一段时间后溶液的碱性增强
装置工作时两极均有气泡产生,工作一段时间后溶液的碱性增强
B.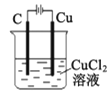 装置工作一段时间后碳极上有红色物质析出
装置工作一段时间后碳极上有红色物质析出
C.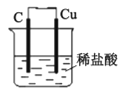 装置可以模拟金属的析氢腐蚀,铜棒一极的电极反应式为:2H++ 2e-=H2↑
装置可以模拟金属的析氢腐蚀,铜棒一极的电极反应式为:2H++ 2e-=H2↑
D.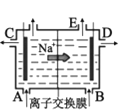 是阳离子交换膜法电解饱和食盐水原理示意图,E出口有黄绿色气体放出
是阳离子交换膜法电解饱和食盐水原理示意图,E出口有黄绿色气体放出
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
【题目】回答有关问题:
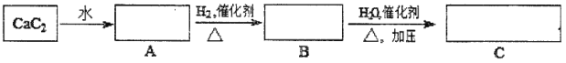
(1)A→B的反应类型是___________,实验室制取B的反应条件是________________。
(2)A和氯化氢为原料可以制得塑料聚氯乙烯。写出制备过程中最后一步发生的方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机化合物的说法错误的是
A.葡萄糖和淀粉互为同系物
B.植物油含不饱和脂肪酸甘油酯,与氢气加成后生成固态的人造脂肪
C.对三联苯(![]() )分子中在同一直线上的原子最多有8个
)分子中在同一直线上的原子最多有8个
D.分子式为C7H16的烷烃,最长碳链上有5个碳原子的同分异构体共有5种(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分为Al2O3,还有少量杂质)中提取铝的工艺流程及步骤如下:
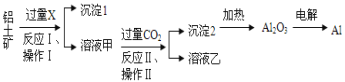
试回答下列问题:
(1)试剂X为__________;
(2)写出试剂X溶解Al2O3的化学方程式________
(3)操作Ⅰ、操作Ⅱ均为_________(填操作名称);
(4)金属铝与氧化铁混合在高温下,会发生剧烈的反应,该反应的化学方程式为_______;
(5)反应Ⅱ的离子方程式为______;
(6)电解熔融氧化铝制取金属铝,若有0.6 mol电子发生转移,理论上能得到金属铝的质量是________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 是一种重要的化工原料,下列有关说法错误的是( )
是一种重要的化工原料,下列有关说法错误的是( )
A.该物质的分子式为C7H8O
B.该物质属于芳香族化合物的同分异构体共有4种(不包括其本身)
C.该分子中所有碳原子共平面
D.1 mol该物质与足量的Na反应可产生11.2 L H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年的化学诺贝尔奖颁给了为锂电池研究作出贡献的三位科学家。有两种常见锂电池:一种是采用镍钴锰酸锂Li(NiCoMn)O2或镍钴铝酸锂为正极的“三元材料锂电池”;另一种是采用磷酸铁锂为正极的磷酸铁锂电池。请回答下列问题:
(1)基态钴原子的价电子排布式为____,Mn位于元素周期表的____ 区(填“s”或“p”或“d”或“ds”或“f”)。
(2)磷元素可以形成多种含氧酸H3PO4、H3PO2、H3PO3、HPO3,这四种酸中酸性最强的是___。PO43-的空间构型是 ___,中心原子的杂化方式是 ____。
(3)CoO、MnO两种氧化物的熔点由高到低的顺序是 ___,原因是 ___。
(4)PH3是____分子(填“极性”或“非极性”),其在水中的溶解性比NH3小,原因是 _____
(5)硫化锂Li2S(摩尔质量Mgmol-1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如图。若硫化锂晶体的密度为ag.cm-3,则距离最近的两个S2-的距离是___nm。(用含a、M、NA的计算式表示)
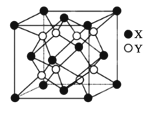
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备 BaCl2·2H2O有如下两种途径。
途径 1:以重晶石(主要成分BaSO4)为原料,流程如下:
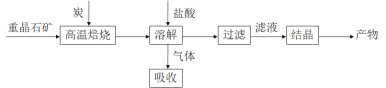
(1)写出“高温焙烧”时反应的化学方程式:_____________________________________。
(2)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为_____________。
(3)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,![]() =___________。 [Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
=___________。 [Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
途径 2:以毒重石(主要成分BaCO3,含Ca2+、Mg2+、Fe3+等杂质)为原料,流程如下:
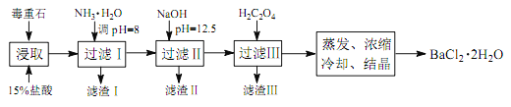
已知:Ksp(BaC2O4)=1.6×10-7, Ksp(CaC2O4)=2.3×10-9
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的 pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的 pH | 13.9 | 11.1 | 3.7 |
(4)为提高矿石的浸取率,可采取的措施是_________。
(5)加入 NH3·H2O 调节 pH=8 可除去___________(填离子符号),滤渣Ⅱ中含_________(填化学式)。加入 H2C2O4时应避免过量,原因是_________。
(6)重量法测定产品纯度的步骤为:准确称取 m g BaCl2·2H2O试样,加入100 mL水, 用3 mL 2 mol·L-1 的 HCl溶液加热溶解。边搅拌,边逐滴加入0.1 mol·L-1 H2SO4 溶液。待BaSO4完全沉降后,过滤,用0.01 mol·L-1 的稀H2SO4洗涤沉淀 3~4 次,直至洗涤液中不含Cl-为止。将沉淀置于坩埚中经烘干灼烧至恒重,称量为n g。则BaCl2·2H2O的质量分数为_________。
(7)20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g·L-1)如图所示。下列叙述正确的是_______________
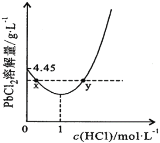
A.盐酸浓度越大,Ksp(PbCl2)越大
B.PbCl2能与一定浓度的盐酸反应
C.x、y两点对应的溶液中c(Pb2+)相等
D.往含Pb2+的溶液中加入过量浓盐酸,可将Pb2+完全转化为PbCl2(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中的实验装置可用于制取乙炔。完成下列填空:
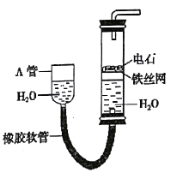
(1)图中,A管的作用是___,制取乙炔的化学方程式是___。
(2)乙炔燃烧时的实验现象是___。燃烧时,火焰温度非常高,被称为“氧炔焰”,氧炔焰的用途是___。
(3)使用如图装置反应时,反应速度依旧较快,因此可以对反应物进行调整,具体调整的方案为:___。
(4)乙炔气体本是无色无味气体,而通过电石制备产生的乙炔中有臭味。为了除去所得乙炔气体中的杂质,应将其通过___性溶液(选填“酸”、“中”或“碱”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组以亚硝酸钠(NaNO2)溶液为研究对象,探究NO2-的性质。
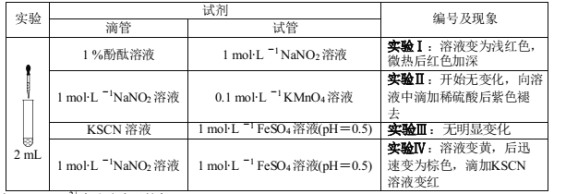
资料:[Fe(NO)] 2+在溶液中呈棕色。
(1)结合化学用语解释实验Ⅰ“微热后红色加深”的原因 ___;
(2)实验Ⅱ证明NO2-具有 ____性;
(3)实验Ⅳ证明NO2-具有_____性;写出此反应溶液先变黄后变成棕色的离子反应方程式 ____;
(4)探究实验Ⅳ中的棕色溶液
①为确定棕色物质是NO 与 Fe2+ 而非与 Fe3+ 发生络合反应的产物,设计如下实验,请补齐实验方案。
实验 | 溶液a | 现象 |
| 1mol/LFeSO4溶液(pH=0.5) | 溶液由________色迅速变为____色 |
__________________ | 无明显变化 |
②加热实验Ⅳ中的棕色溶液,有气体逸出,该气体在接近试管口处变为红棕色,溶液中有红褐色沉淀生成。解释上述现象产生的原因 ___ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com