
����Ŀ����ҵ���Ʊ� BaCl2��2H2O����������;����
;�� 1�����ؾ�ʯ����Ҫ�ɷ�BaSO4��Ϊԭ�ϣ��������£�
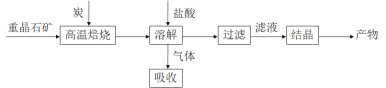
��1��д�������±��ա�ʱ��Ӧ�Ļ�ѧ����ʽ��_____________________________________��
��2�������ù���NaOH��Һ���գ��õ����ơ�Na2Sˮ������ӷ���ʽΪ_____________��
��3����BaCl2��Һ�м���AgNO3��KBr�������ֳ�������ʱ��![]() =___________�� [Ksp(AgBr)=5.4��10-13��Ksp(AgCl)=2.0��10-10]
=___________�� [Ksp(AgBr)=5.4��10-13��Ksp(AgCl)=2.0��10-10]
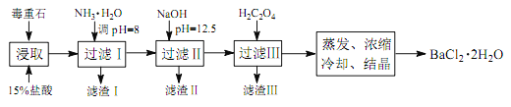
;�� 2���Զ���ʯ(��Ҫ�ɷ�BaCO3����Ca2+��Mg2+��Fe3+������)Ϊԭ�ϣ��������£�
��֪��Ksp(BaC2O4)��1.6��10��7�� Ksp(CaC2O4)��2.3��10��9
Ca2+ | Mg2+ | Fe3+ | |
��ʼ����ʱ�� pH | 11.9 | 9.1 | 1.9 |
��ȫ����ʱ�� pH | 13.9 | 11.1 | 3.7 |
��4��Ϊ��߿�ʯ�Ľ�ȡ�ʣ��ɲ�ȡ�Ĵ�ʩ��_________��
��5������ NH3��H2O ���� pH=8 �ɳ�ȥ___________�������ӷ��ţ����������к�_________���ѧʽ�������� H2C2O4ʱӦ���������ԭ����_________��
��6���������ⶨ��Ʒ���ȵIJ���Ϊ��ȷ��ȡ m g BaCl2��2H2O����������100 mLˮ�� ��3 mL 2 mol��L��1 �� HCl��Һ�����ܽ⡣�߽��裬����μ���0.1 mol��L��1 H2SO4 ��Һ����BaSO4��ȫ�������ˣ���0.01 mol��L��1 ��ϡH2SO4ϴ�ӳ��� 3~4 �Σ�ֱ��ϴ��Һ�в���Cl��Ϊֹ�����������������о�������������أ�����Ϊn g����BaCl2��2H2O����������Ϊ_________��
��7��20��ʱ��PbCl2(s)�ڲ�ͬŨ�������е�����ܽ���(��λ��g��L-1)��ͼ��ʾ������������ȷ����_______________
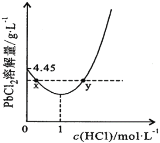
A������Ũ��Խ��Ksp(PbCl2)Խ��
B��PbCl2����һ��Ũ�ȵ����ᷴӦ
C��x��y�����Ӧ����Һ��c(Pb2+)���
D������Pb2+����Һ�м������Ũ���ᣬ�ɽ�Pb2+��ȫת��ΪPbCl2(s)
���𰸡�BaSO4+4C![]() 4CO��+BaS S2-+H2O
4CO��+BaS S2-+H2O![]() HS-+OH-��HS-+H2O
HS-+OH-��HS-+H2O![]() H2S+OH-
H2S+OH- ![]() ����ʯ���飬���裬�ʵ������¶ȵ� Fe3+ Mg(OH)2��Ca(OH)2 H2C2O4�����ᵼ������BaC2O4��������Ʒ�IJ�������
����ʯ���飬���裬�ʵ������¶ȵ� Fe3+ Mg(OH)2��Ca(OH)2 H2C2O4�����ᵼ������BaC2O4��������Ʒ�IJ������� ![]() B
B
��������
��1��������ͼ֪���±���ʱΪ�ؾ�ʯ���̿����������ԭ��Ӧ������̿�������ʿ�֪��ӦΪ��BaSO4+4C![]() 4CO��+BaS����Ϊ��BaSO4+4C
4CO��+BaS������BaSO4+4C![]() 4CO��+BaS��
4CO��+BaS��
��2��Na2SΪǿ�������Σ������������ˮ���������H+����������ᣬ��ˮ������ӷ���ʽΪ��S2-+H2O![]() HS-+OH-��HS-+H2O
HS-+OH-��HS-+H2O![]() H2S+OH-������S2-+H2O
H2S+OH-������S2-+H2O![]() HS-+OH-��HS-+H2O
HS-+OH-��HS-+H2O![]() H2S+OH-��
H2S+OH-��
��3�����ݳ����ܽ�ƽ�ⳣ������ʽ�У�![]() ��
��![]() �������ֳ�������ʱ�У�
�������ֳ�������ʱ�У�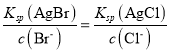 ����
����![]()
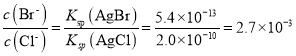 ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��4����߿�ʯ��ȡ�ʣ��ɲ�ȡ�Ĵ�ʩ�У����衢�����¶ȡ��ӳ�����ʱ�䡢���������Ũ�ȡ������ʯ����Ӵ�����ȣ��ʴ�Ϊ������ʯ���飬���裬�ʵ������¶ȵȣ�
��5����������ͼ�����������ݿ�֪������NH3��H2O����pH=8ʱ��ֻ��Fe3+��ȫ������ȥ������NaOH������pH=12.5���Աȱ��������ݿ�֪����ʱMg2+��ȫ������Ca2+���ֳ����������������к�Mg(OH)2��Ca(OH)2��������֪�����������������������BaC2O4������ʹ�����ղ���������١��ʴ�Ϊ��Fe3+��Mg(OH)2��Ca(OH)2��H2C2O4�����ᵼ������BaC2O4��������Ʒ�IJ������٣�
��6�����������֪���ij���ΪBaSO4������Ϊng���������ʵ���![]() ������Baԭ���غ㣬��BaCl2��2H2O�����ʵ���Ϊ
������Baԭ���غ㣬��BaCl2��2H2O�����ʵ���Ϊ![]() ���ʲ�Ʒ����=
���ʲ�Ʒ����=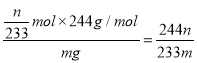 ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��7������ͼ��������ĺ��弰ͼ��ı仯���������ܵ���ʵij����ܽ�ƽ�⼰��Ӱ�����ط������
A��Ksp(PbCl2)ֻ���¶��й�ϵ���¶Ȳ��䣬Ksp(PbCl2)���䣬A�����
B������ͼ��֪������Ũ�ȴ���1mol/Lʱ��PbCl2���ܽ��������Ũ�ȵ������������PbCl2����һ��Ũ�ȵ����ᷴӦ��B����ȷ��
C��x��y�����Ӧ����Һ��c��Cl-����ͬ����c(Pb2+)���ȣ�C�����
D������ͼ������Pb2+����Һ�м���Ũ����Խ�࣬PbCl2�ܽ��Խ���ܽ�Pb2+��ȫת��Ϊ(PbCl2)(s)��D�����
��ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ũ�Ⱦ�Ϊ0.5mol��L-1�İ�ˮ��KOH��Һ�ֱ���뵽���ݾ�Ϊ20mLc1mol��L-1��AlCl3��Һ�У������Һ�ĵ�����������������ϵ��ͼ��ʾ������˵����ȷ����
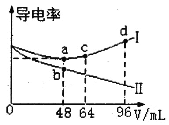
A.c1=0.2
B.b��ʱ��Һ������Ũ�ȣ�c(C1-)>c(NH4+)>c(OH-)>c(H+)
C.ac�η����ķ�ӦΪ��A1(OH)3+OH-==[Al(OH)4]-
D.d��ʱ��Һ�У�c(K+)+c(H+)==[Al(OH)4]-+c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���Ľṹ��ʽ��ͼ��ʾ,����˵���в���ȷ����(����)
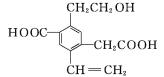
A.1 mol���л�������Ľ����Ʒ�Ӧ����������1.5 mol H2
B.���л����������Na��NaOH��NaHCO3�����ʵ���֮��Ϊ3��2��2
C.����������KMnO4��Һ�������е�̼̼˫��
D.���л����ܹ��ڴ��������·���������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йص绯ѧ����������ȷ���ǣ� ��
A. װ�ù���ʱ�����������ݲ���������һ��ʱ�����Һ�ļ�����ǿ
װ�ù���ʱ�����������ݲ���������һ��ʱ�����Һ�ļ�����ǿ
B.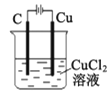 װ�ù���һ��ʱ���̼�����к�ɫ��������
װ�ù���һ��ʱ���̼�����к�ɫ��������
C.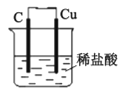 װ�ÿ���ģ����������ⸯʴ��ͭ��һ���ĵ缫��ӦʽΪ��2H++ 2e-=H2��
װ�ÿ���ģ����������ⸯʴ��ͭ��һ���ĵ缫��ӦʽΪ��2H++ 2e-=H2��
D.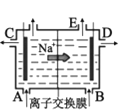 �������ӽ���Ĥ����ⱥ��ʳ��ˮԭ��ʾ��ͼ��E�����л���ɫ����ų�
�������ӽ���Ĥ����ⱥ��ʳ��ˮԭ��ʾ��ͼ��E�����л���ɫ����ų�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ����;�ܹ�Ļ�����Ʒ�����Ժ�Σ����С���ǰ�ȫ�Ժܸߵ��л��ܼ�����������Ȼ���ϳ���֬����֬�����л������������ȶ��к�ǿ���ܽ�������������Ϊ���Ӽ���ϴ���Ͷ����л��ϳɲ��ϡ���ͨ�����·�Ӧԭ����ȡ�����ѣ�
2CH3CH2CH2CH2OH![]() CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
��֪������ʵIJ�����Ϣ���£�
�е�(��) | �ܶ�(g/cm3) | �ܽ��(g) | ��Է������� | |
������ | 117.7 | 0.81 | 7.9 | 74 |
������ | 142 | 0.77 | ������ˮ | 130 |
ij���⻯ѧѧϰС���������������������ʵ�鲽��ϳ������ѣ�
����100 mL������ƿ�м���30.0 mL��������5.0 mLŨ����ͼ�����ʯ�����ҡ�ȡ��ڷ�ˮ���м���3.0 mL����ʳ��ˮ����ͼ����װ��������ͨ����ˮ��
�ڷ�Ӧ���ڵ������ϼ��ȣ�ʹƿ��Һ���У�������ӦԼ1Сʱ������Һ������ˮ��ʱ����ˮ���ų�һ����ˮ����ˮ�㲻�ٱ仯��ƿ�з�Ӧ�¶ȴ�150 �棬��Ӧ��������ɣ�ֹͣ���ȣ�
��������ӦҺ��ȴ���·�ˮ�����������ij�����װ����ͼ�����ټӼ�����ʯ�������ռ���֣�
�ܾ��ƣ������Һ����ʢ��10 mLˮ�ķ�Һ©���У������ҡ��������ȥˮҺ���л���������5 mLˮ��3 mL 5% NaOH��Һ��3 mLˮ��3 mL�����Ȼ�����Һϴ�ӣ���ȥˮ�㣬���������ྻ�����С��ƿ�У�Ȼ�����0.2��0.4 9��ˮ�Ȼ��ƣ��ٽ�Һ��ת��װ�ñ��н��������ռ������9.0 mL��
��. 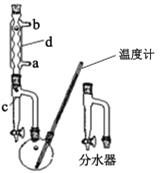 ��.
��. ![]() ��.
��.
��������ϲ����ش��������⣺
(1)�Ʊ������ѵķ�Ӧ������___������d��������____��
(2)�ڲ�����������Լ���˳����____�����װ���ң�װ�ü��ŵ��� ___��
(3)�ڲ�����в��õ������ȶ������þƾ���ֱ�Ӽ��ȵ�ԭ�������____��
(4)�ڲ�������ռ�������˵��¶ȷ�ΧΪ____(����ȷ�𰸱��)��
A.115�桫ll9�� B.140�桫144�� C. 148�桫152��
(5)�ھ����У��л�����____��(����������������)��������ˮ�Ȼ��Ƶ�������____��
(6)��С��ʵ������������ѵIJ���ԼΪ ___%(����������һλС��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�������Ԥ��ʵ��Ŀ�Ļ�����ʵ�����һ�µ���
ѡ�� | ʵ����������� | Ԥ��ʵ��Ŀ�Ļ���� |
A | ����֧ʢ��KI3����Һ���Թ��У��ֱ�μӵ�����Һ��AgNO3��Һ��ǰ����Һ�����������л�ɫ���� | KI3��Һ�д���ƽ��:I3- |
B | ��1 mLŨ�Ⱦ�Ϊ0.05 mol��L-l NaCl��NaI�Ļ����Һ�еμ�2��0.01 mol��L-l AgNO3��Һ���������ʻ�ɫ | Ksp(AgCl)<Ksp(AgI) |
C | �����£��� pH ��ֽ�ֱ�ⶨŨ��Ϊ 0.1mol/L NaClO��Һ��0.1mol/L CH3COONa��Һ��pH | �Ƚ�HC1O��CH3COOH������ǿ�� |
D | Ũ�������Ҵ�180�湲�ȣ��Ƶõ�����ͨ������KMnO4 ��Һ����Һ��ɫ��ȥ | �Ƶõ�����Ϊ��ϩ |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ������������ĺ�������Ų���������������ʣ���Ϊ��ѧ�о����ص��ǰ�ء�
(l������Ԫ�ش������ڱ���____����f ����
(2������Ԫ�����γɼ���������γɶ�����λ������
�� ͨ����d���ȫ�ջ�ȫ���Ĺ��ɽ���������ˮ�����γɵ����������ɫ����������ɫ����[Co(H2O)6]2+�Էۺ�ɫ���ݴ��жϣ�[Mn(H2O)6]2+____����������������������ɫ��
�� Ni2+���γɶ���������Ni(CN)42-��д��CN-�ĵ���ʽ____������������CN-��NO2-�滻���õ��������ֻ�����ֽṹ����Ni(CN)42-�Ŀռ乹����_____, NO2-�Ŀռ乹����_____������Nԭ�ӵ��ӻ���ʽ��_____��
�� �ӽṹ�Ƕȷ������Ƚ�CoF2��CoCl2������۵�ߵ�___________��
��3����ͭ�Ƚ������Ͻ����������ʯīϩ�Ĵ�������ͼ��һ��ͭ��Ͻ�ľ���ʾ��ͼ��

�� �ڸ�ͭ��Ͻ�ľ����У���Cuԭ�Ӿ�������������Auԭ����Ϊ_______��
�� ԭ�����������������ʾ�����ڲ���ԭ�����λ�õ�ָ�꣬��A��ԭ���������Ϊ��0,0,0)��B��ԭ���������Ϊ��0,1,0) , C��ԭ���������Ϊ��l,0,0)����D��ԭ�����������Ϊ_________��
�� ��Au��Cuԭ�Ӱ뾶�ֱ�Ϊr1��r2,��þ����е�ԭ�ӿռ�������Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ������������M��N���϶�����ͬ����Ԫ���һ�ѧ�������Ƶ��ǣ� ��
A.ԭ�Ӻ�������Ų�ʽ��MΪ1s22s2��NΪ1s2
B.�ṹʾ��ͼ��M![]() ��N
��N![]()
C.Mԭ�ӻ�̬2p�������һ�ԳɶԵ��ӣ�Nԭ�ӻ�̬3p�������һ�ԳɶԵ���
D.Mԭ�ӻ�̬2p�������1��δ�ɶԵ��ӣ�Nԭ�ӻ�̬3p�������1��δ�ɶԵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������з�������ͬ���ǣ� ��
A.2L CO��2L CO2B.9gH2O�ͱ�״���� 11.2LCO2
C.��״����1molO2��22.4LH2OD.0.2molH2��4.48LHCl����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com