
����Ŀ������Ԫ������������ĺ�������Ų���������������ʣ���Ϊ��ѧ�о����ص��ǰ�ء�
(l������Ԫ�ش������ڱ���____����f ����
(2������Ԫ�����γɼ���������γɶ�����λ������
�� ͨ����d���ȫ�ջ�ȫ���Ĺ��ɽ���������ˮ�����γɵ����������ɫ����������ɫ����[Co(H2O)6]2+�Էۺ�ɫ���ݴ��жϣ�[Mn(H2O)6]2+____����������������������ɫ��
�� Ni2+���γɶ���������Ni(CN)42-��д��CN-�ĵ���ʽ____������������CN-��NO2-�滻���õ��������ֻ�����ֽṹ����Ni(CN)42-�Ŀռ乹����_____, NO2-�Ŀռ乹����_____������Nԭ�ӵ��ӻ���ʽ��_____��
�� �ӽṹ�Ƕȷ������Ƚ�CoF2��CoCl2������۵�ߵ�___________��
��3����ͭ�Ƚ������Ͻ����������ʯīϩ�Ĵ�������ͼ��һ��ͭ��Ͻ�ľ���ʾ��ͼ��

�� �ڸ�ͭ��Ͻ�ľ����У���Cuԭ�Ӿ�������������Auԭ����Ϊ_______��
�� ԭ�����������������ʾ�����ڲ���ԭ�����λ�õ�ָ�꣬��A��ԭ���������Ϊ��0,0,0)��B��ԭ���������Ϊ��0,1,0) , C��ԭ���������Ϊ��l,0,0)����D��ԭ�����������Ϊ_________��
�� ��Au��Cuԭ�Ӱ뾶�ֱ�Ϊr1��r2,��þ����е�ԭ�ӿռ�������Ϊ__________��
���𰸡� d��ds �� ![]() ƽ�������� ������ sp2 CoF2��CoCl2���۵�ߣ�ԭ���Ƿ����Ӱ뾶�������Ӱ뾶С��CoF2�ľ����ܸ��� 4 ��1/2,1,1/2��
ƽ�������� ������ sp2 CoF2��CoCl2���۵�ߣ�ԭ���Ƿ����Ӱ뾶�������Ӱ뾶С��CoF2�ľ����ܸ��� 4 ��1/2,1,1/2�� ![]() ��
��![]()
��������(l)���Ԫ�����ڱ��Ľṹ��֪����Ԫ�ش������ڱ���d����ds ����f ����
(2)�� ��̬Mnԭ�ӵĵ����Ų�ʽΪ[Ar]3d54s2��Mn2+�ĵ����Ų�ʽΪ[Ar]3d5��d���Ϊ������ṹ����ˮ�����γɵ������[Mn(H2O)6]2+����ɫ��
��CN-��N2�ǵȵ����壬�������ʽΪ![]() ������������CN-��NO2-�滻���õ��������ֻ�����ֽṹ��˵������ͬ���칹�壬��Ni(CN)42-�Ŀռ乹����ƽ�������Σ�NO2-��Nԭ�Ӽ۵��Ӷ���Ϊ��
������������CN-��NO2-�滻���õ��������ֻ�����ֽṹ��˵������ͬ���칹�壬��Ni(CN)42-�Ŀռ乹����ƽ�������Σ�NO2-��Nԭ�Ӽ۵��Ӷ���Ϊ�� ![]() =3��Nԭ�ӵ��ӻ���ʽ��sp2���γ������ӻ���������������ӻ������O�γ����������ۼ���һ�Թ¶Ե���ռ��ʣ����ӻ��������ռ乹��ΪV�λ������� ��
=3��Nԭ�ӵ��ӻ���ʽ��sp2���γ������ӻ���������������ӻ������O�γ����������ۼ���һ�Թ¶Ե���ռ��ʣ����ӻ��������ռ乹��ΪV�λ������� ��
�� �����Ӱ뾶�������Ӱ뾶С��CoF2�ľ����ܱ�CoCl2�����ܴ���CoF2��CoCl2���۵�ߣ�
(3)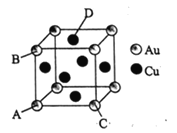
�� ��ͭ��Ͻ�ľ���ṹ��֪����Cuԭ�Ӿ�������������AuΪͬһƽ���ϵ�4��Auԭ�ӣ�
�� ��A��ԭ���������Ϊ(0,0,0)��B��ԭ���������Ϊ(0,1,0) ��C��ԭ���������Ϊ(l,0,0)��˵�������߳�Ϊ1����D��ԭ�����������Ϊ(![]() ��1��
��1�� ![]() )
)
�� ÿ�������к��е�ͭԭ����=6��![]() =3�����еĽ�ԭ����=
=3�����еĽ�ԭ����=![]() ��8=1���������Ļ�ѧʽ�ɱ�ʾΪ��Cu3Au��AuCu3����Cuԭ�Ӻ�Auԭ�������Ϊ
��8=1���������Ļ�ѧʽ�ɱ�ʾΪ��Cu3Au��AuCu3����Cuԭ�Ӻ�Auԭ�������Ϊ![]() ��(3r23+r13) ������
��(3r23+r13) ������![]() ��֪�����ı߳�Ϊ
��֪�����ı߳�Ϊ![]() (r1+r2)�����������Ϊ2
(r1+r2)�����������Ϊ2![]() (r1+r2)3���ռ�������Ϊ
(r1+r2)3���ռ�������Ϊ![]() ��100%=[
��100%=[![]() ��(3r23+r13)]��[2
��(3r23+r13)]��[2![]() (r1+r2)3]=
(r1+r2)3]=![]() ��
��


 ��Ӣ���㿨ϵ�д�
��Ӣ���㿨ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʢ�NaHCO3 ��Al ��Fe2O3 ��Al(OH)3 ��MgO�У����������ᷴӦ������������������Һ��Ӧ���ǣ� ��
A. �ڢۢ� B. �٢ܢ� C. �٢ڢ� D. ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Լ��У�����ʹFe2��ת��ΪFe3������( )
������ ��NaCl��Һ ��KMnO4��Һ ��ϡ���� ������ ��NaNO3��Һ
A���٢ڢ� B���٢ۢ�
C���ڢܢ� D���ڢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������뻯ѧ�����йص�˵����ȷ���ǣ�������
A.���Ϸ�Ӧ��Ϊ������ԭ��Ӧ
B.�����ܸı���淴Ӧ�ﵽƽ���ʱ��
C.���������������������
D.ʯ���ǻ���������Ʒ����Ϊ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ɱ���һ�������¿����γ�CO2���壬CO2������һ���������ֿ��������þ��Ӧ��������þ��̼���������仯��������Ҫ�˷����������ֱ��ǣ�������
A. ���Ӽ�����������ѧ��B. ��ѧ������ѧ��
C. ��ѧ�������Ӽ�������D. ���Ӽ������������Ӽ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.��ͼ����пԭ���װ�õ�ʾ��ͼ��������ͭΪ�������Һ���ش��������⣺

пΪ__�����õ缫�Ϸ���__��Ӧ����������������ԭ�������缫��ӦʽΪ__����ԭ��ص��ܷ�Ӧ���ӷ���ʽΪ__��
II.��1�������Ƶĵ���ʽ��_____________��
��2����������ˮ��Ӧ�Ļ�ѧ����ʽ��__________________��
��3�������������ᷴӦ����_______���Ρ�
��4�����������������İ뾶��С�Ƚϣ� r��Na+��___r��N3����������ڡ�����С�ڡ����ڡ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������dzµ��㡱��������Ϊ���ڴ������������������ζ��������������ʵ��������Ҳ��������ͼ��ʾ��װ������ȡ�����������Իش��������⣺

��1��д����CH3COOH��C2H518OH��ȡ���������Ļ�ѧ��Ӧ����ʽ__________��
��2���÷�Ӧ�����һ������Ũ���ᣬ��Ũ�������Ҫ������_______________��
��3���ұ��Թ�����ʢ����̼������Һ����Ҫ������_______��
��4��װ����ͨ�����ĵ���Ҫ���ڱ���̼������Һ��Һ���ϣ����ܲ�����Һ�У�Ŀ���Ƿ�ֹ___��
��5����Ҫ���Ƶõ��������������������Ҫʹ�õIJ���������_________���������������ƣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϵͳ�������������Ʋ���ȷ���ǣ� ��
A. 1һ������B. 2һ������
C. 2��2һ��������D. 3һ�һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ������ˮ��ɲ���ij�л�������A��A�ڲ�ͬ�������������£���������B��C6H12O7����C��C6H10O8����B��C�����ܷ���������Ӧ��A��B��C�����Ա�ǿ��ԭ����ԭ��ΪD��C6H14O6����B��ˮ�ɵõ���Ԫ�����������E����Ԫ�����������F��

��֪��������ʱ����������״����ǣ�RCHO���ף�R��CH2OH��֮��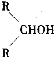 ���ѡ��������пո�����дA��B��C��D��E��F�Ľṹ��ʽ��
���ѡ��������пո�����дA��B��C��D��E��F�Ľṹ��ʽ��
A�� B�� C��
D�� E�� F��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com