
【题目】 是一种重要的化工原料,下列有关说法错误的是( )
是一种重要的化工原料,下列有关说法错误的是( )
A.该物质的分子式为C7H8O
B.该物质属于芳香族化合物的同分异构体共有4种(不包括其本身)
C.该分子中所有碳原子共平面
D.1 mol该物质与足量的Na反应可产生11.2 L H2
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】实验室用浓度为0.500mol/L的标准氢氧化钠溶液来测定未知浓度的盐酸。在锥形瓶中放入20.00mL的待测溶液,再滴加2滴酚酞,摇匀。用标准氢氧化钠溶液滴定,直到滴入最后一滴氢氧化钠溶液,指示剂的颜色_______,并在半分钟内溶液颜色不发生变化,停止滴定,记录读数。数据如表:
次数 | 滴定前(mL) | 滴定后(mL) |
1 | 0.40 | 21.10 |
2 | 0.10 |
第2次滴定后滴定管的读数如图所示。根据表中的数据计算出盐酸的浓度为_____mol/L。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气和燃煤尾气是造成雾霾的主要原因之一。
(1)工业上利用甲烷催化还原NO,可减少氮氧化物的排放。
已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ·mol1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH =-1160kJ·mol1
甲烷直接将NO2还原为N2的热化学方程式为____________________________。
(2)减少汽车尾气污染的原理为2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH <0。向恒温恒容密闭容器中充入NO和CO,用传感器测得的数据如下表所示:
N2(g)+2CO2(g) ΔH <0。向恒温恒容密闭容器中充入NO和CO,用传感器测得的数据如下表所示:
时间/s | 0 | 1 | 2 | 3 | 4 |
c(NO)/×10-3mol·L1 | 9.00 | 4.00 | 2.00 | 1.00 | 1.00 |
c(CO)/×10-3mol·L1 | 9.00 | 4.00 | 2.00 | 1.00 | 1.00 |
①为了提高尾气处理的效果,可采取的措施有____________(写出两种即可)。
②此条件下达到平衡时,计算该反应的平衡常数K=____________________。
(3)工业上用氢氧化钠溶液来同时吸收SO2和氮的氧化物气体(NOx),可得到Na2SO3、NaHSO3、NaNO2、NaNO3等溶液。(已知:常温下,HNO2的电离常数为Ka=7×10-4,H2SO3的电离常数为Ka1=1.2×10-2、Ka2=5.8×10-8)。
①常温下,相同浓度的Na2SO3、NaNO2溶液中pH较大的是________溶液。
②常温下,NaHSO3显_________性(填“酸”“碱”或“中”),判断的理由是________________________________________________(通过计算说明)。
(4)铈素(Ce)常见有+3、+4两种价态。NO可以被含Ce4+的溶液吸收,生成NO2-、NO3-(二者物质的量之比为1∶1)。可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如图所示。

①Ce4+从电解槽的__________(填字母代号)口流出。
②写出阴极的电极反应式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,下列说法中不正确的是( )
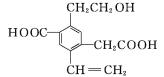
A.1 mol该有机物和过量的金属钠反应最多可以生成1.5 mol H2
B.该有机物最多消耗Na、NaOH、NaHCO3的物质的量之比为3∶2∶2
C.可以用酸性KMnO4溶液检验其中的碳碳双键
D.该有机物能够在催化剂作用下发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是

A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电化学的叙述,正确的是( )
A. 装置工作时两极均有气泡产生,工作一段时间后溶液的碱性增强
装置工作时两极均有气泡产生,工作一段时间后溶液的碱性增强
B.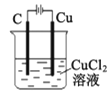 装置工作一段时间后碳极上有红色物质析出
装置工作一段时间后碳极上有红色物质析出
C.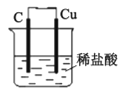 装置可以模拟金属的析氢腐蚀,铜棒一极的电极反应式为:2H++ 2e-=H2↑
装置可以模拟金属的析氢腐蚀,铜棒一极的电极反应式为:2H++ 2e-=H2↑
D.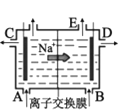 是阳离子交换膜法电解饱和食盐水原理示意图,E出口有黄绿色气体放出
是阳离子交换膜法电解饱和食盐水原理示意图,E出口有黄绿色气体放出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醚是一种用途很广的化工产品,毒性和危险性小,是安全性很高的有机溶剂,对许多天然及合成油脂、树脂、橡胶、有机酸酯、生物碱等都有很强的溶解能力,还可作为电子级清洗剂和多种有机合成材料。可通过以下反应原理制取正丁醚:
2CH3CH2CH2CH2OH![]() CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
己知相关物质的部分信息如下:
沸点(℃) | 密度(g/cm3) | 溶解度(g) | 相对分子质量 | |
正丁醇 | 117.7 | 0.81 | 7.9 | 74 |
正丁醚 | 142 | 0.77 | 不溶于水 | 130 |
某课外化学学习小组查阅相关资料设计了以下实验步骤合成正丁醚:
①在100 mL两口烧瓶中加入30.0 mL正丁醇、5.0 mL浓硫酸和几粒沸石,充分摇匀。在分水器中加入3.0 mL饱和食盐水,按图甲组装仪器,接通冷凝水;
②反应:在电热套上加热,使瓶内液体微沸,回流反应约1小时。当馏液充满分水器时,打开分水器放出一部分水。当水层不再变化,瓶中反应温度达150 ℃,反应己基本完成,停止加热;
③蒸馏:待反应液冷却后,拆下分水器,将仪器改成蒸馏装置如图丙,再加几粒沸石,蒸馏,收集馏分;
④精制:将馏出液倒入盛有10 mL水的分液漏斗中,充分振摇,静置弃去水液,有机层依次用5 mL水,3 mL 5% NaOH溶液、3 mL水和3 mL饱和氯化钙溶液洗涤,分去水层,将产物放入洁净干燥的小锥形瓶中,然后加入0.2~0.4 9无水氯化钙,再将液体转入装置丙中进行蒸馏,收集到馏分9.0 mL。
甲. 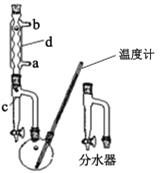 乙.
乙. ![]() 丙.
丙.
请根据以上操作回答下列问题:
(1)制备正丁醚的反应类型是___,仪器d的名称是____。
(2)在步骤①中添加试剂的顺序是____。相比装置乙,装置甲的优点是 ___。
(3)在步骤②中采用电热套加热而不采用酒精灯直接加热的原因可能是____。
(4)在步骤③中收集馏分适宜的温度范围为____(填正确答案标号)。
A.115℃~ll9℃ B.140℃~144℃ C. 148℃~152℃
(5)在精制中,有机层在____层(填“上”或“下”),加入无水氯化钙的作用是____。
(6)本小组实验后所得正丁醚的产率约为 ___%(计算结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡元素由于其特殊的核外电子排布而其有特殊的性质,成为化学研究的重点和前沿。
(l)过波元素处于周期表的____区和f 区。
(2)过渡元素能形成简单化合物,还能形成多种配位化合物
① 通常,d轨道全空或全满的过渡金属离子与水分子形成的配合物无颜色,否则有颜色。如[Co(H2O)6]2+显粉红色,据此判断,[Mn(H2O)6]2+____(填“有”或“无”)颜色。
② Ni2+可形成多种配合物,如Ni(CN)42-。写出CN-的电子式____,若其中两个CN-被NO2-替换,得到的配合物只有两种结构,则Ni(CN)42-的空间构型是_____, NO2-的空间构型是_____,其中N原子的杂化方式是_____。
③ 从结构角度分析并比较CoF2与CoCl2晶体的熔点高低___________。
(3)金、铜等金属及合金可用作生产石墨烯的催化剂,下图是一种铜金合金的晶胞示意图:

① 在该铜金合金的晶体中,与Cu原子距离相等且最近的Au原子数为_______。
② 原子坐标参数是用来表示晶胞内部各原子相对位置的指标,若A的原子坐标参数为(0,0,0);B的原子坐标参数为(0,1,0) , C的原子坐标参数为(l,0,0)。则D的原子子坐标参数为_________。
③ 若Au、Cu原子半径分别为r1和r2,则该晶胞中的原子空间利用率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A经李比希法和质谱法分析得知其分子式为C8H8O2,相对分子质量为 136,A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环,且苯环上只有一个取代基,其核磁共振氢谱与红外光谱如图。关于A的下列说法中不正确的是( )
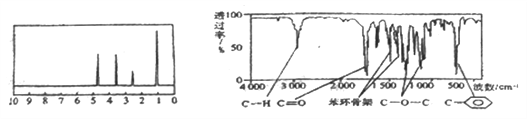
A. A分子属于酯类化合物,在一定条件下能发生水解反应
B. A在一定条件下可与3 mol H2发生加成反应
C. 符合题中A分子结构特征的有机物只有一种
D. 与A属于同类化合物的同分异构体只有2种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com