
【题目】汽车尾气和燃煤尾气是造成雾霾的主要原因之一。
(1)工业上利用甲烷催化还原NO,可减少氮氧化物的排放。
已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ·mol1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH =-1160kJ·mol1
甲烷直接将NO2还原为N2的热化学方程式为____________________________。
(2)减少汽车尾气污染的原理为2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH <0。向恒温恒容密闭容器中充入NO和CO,用传感器测得的数据如下表所示:
N2(g)+2CO2(g) ΔH <0。向恒温恒容密闭容器中充入NO和CO,用传感器测得的数据如下表所示:
时间/s | 0 | 1 | 2 | 3 | 4 |
c(NO)/×10-3mol·L1 | 9.00 | 4.00 | 2.00 | 1.00 | 1.00 |
c(CO)/×10-3mol·L1 | 9.00 | 4.00 | 2.00 | 1.00 | 1.00 |
①为了提高尾气处理的效果,可采取的措施有____________(写出两种即可)。
②此条件下达到平衡时,计算该反应的平衡常数K=____________________。
(3)工业上用氢氧化钠溶液来同时吸收SO2和氮的氧化物气体(NOx),可得到Na2SO3、NaHSO3、NaNO2、NaNO3等溶液。(已知:常温下,HNO2的电离常数为Ka=7×10-4,H2SO3的电离常数为Ka1=1.2×10-2、Ka2=5.8×10-8)。
①常温下,相同浓度的Na2SO3、NaNO2溶液中pH较大的是________溶液。
②常温下,NaHSO3显_________性(填“酸”“碱”或“中”),判断的理由是________________________________________________(通过计算说明)。
(4)铈素(Ce)常见有+3、+4两种价态。NO可以被含Ce4+的溶液吸收,生成NO2-、NO3-(二者物质的量之比为1∶1)。可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如图所示。

①Ce4+从电解槽的__________(填字母代号)口流出。
②写出阴极的电极反应式______________________。
【答案】CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH=-867kJ·mol1 降低温度,或增大压强(或压缩体积),或使用催化活性更好的催化剂等(写出两种即可) 2.56×105 Na2SO3 酸 因为HSO3-的电离常数Ka2=5.8×10-8,水解常数Kh2=![]() ≈8.3×10-13,电离常数大于水解常数,所以溶液显酸性 a 2NO2-+8H++6e=N2↑+4H2O
≈8.3×10-13,电离常数大于水解常数,所以溶液显酸性 a 2NO2-+8H++6e=N2↑+4H2O
【解析】
(1)已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ·mol1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH =-1160kJ·mol1
将第一个方程式加上第二个方程式,再整体除以2得到甲烷直接将NO2还原为N2的热化学方程式为CH4(g)+ 2NO2(g)= N2(g)+ CO2(g)+2H2O(g) ΔH =![]() ;故答案为:CH4(g)+2NO2(g)= N2(g) + CO2(g) + 2H2O(g) ΔH=-867kJ·mol1。
;故答案为:CH4(g)+2NO2(g)= N2(g) + CO2(g) + 2H2O(g) ΔH=-867kJ·mol1。
(2)①该反应是正向为体积减小的放热反应,为了提高尾气处理的效果,可采取的措施有降低温度,或增大压强(或压缩体积),或使用催化活性更好的催化剂等;故答案为:降低温度,或增大压强(或压缩体积),或使用催化活性更好的催化剂等(写出两种即可)。
②此条件下达到平衡时,c(NO)= c(CO) =1.00×10-3mol·L1,Δc(NO)=8.00×10-3mol·L1,c(N2)=Δc(N2)= ![]() Δc(NO)=
Δc(NO)= ![]() ×8.00×10-3mol·L1 =4.00×10-3mol·L1,c(CO2)=Δc(CO2)=Δc(NO)=8.00×10-3mol·L1,因此反应的平衡常数
×8.00×10-3mol·L1 =4.00×10-3mol·L1,c(CO2)=Δc(CO2)=Δc(NO)=8.00×10-3mol·L1,因此反应的平衡常数![]() ;故答案为:2.56×105。
;故答案为:2.56×105。
(3)①常温下,HNO2的电离常数为Ka=7×10-4,H2SO3的电离常数为Ka2=5.8×10-8,因此酸性强弱为HNO2>HSO3-,根据越弱越水解,碱性强,则相同浓度的Na2SO3、NaNO2溶液中pH较大的是Na2SO3溶液;故答案为:Na2SO3。
②常温下,HSO3-的电离常数Ka2=5.8×108,水解常数Kh2=![]() ≈8.3×1013,电离常数大于水解常数,所以溶液显酸性;故答案为:酸;因为HSO3-的电离常数Ka2=5.8×108,水解常数Kh2=
≈8.3×1013,电离常数大于水解常数,所以溶液显酸性;故答案为:酸;因为HSO3-的电离常数Ka2=5.8×108,水解常数Kh2=![]() ≈8.3×1013,电离常数大于水解常数,所以溶液显酸性。
≈8.3×1013,电离常数大于水解常数,所以溶液显酸性。
(4)①Ce3+化合价升高变为Ce4+,失去电子发生氧化反应,在阳极反应,因此Ce4+从电解槽的a口流出;故答案为:a。
②NO2-转化为无毒物质,N化合价降低,得到电子发生还原反应,在阴极反应,因此阴极的电极反应式2NO2- + 8H++6e- = N2↑+4H2O;故答案为:2NO2- + 8H++6e- = N2↑+4H2O。


科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了约翰·班尼斯特·古迪纳夫、迈克尔·斯坦利·惠廷汉姆和吉野彰,以表彰他们对锂离子电池研发的贡献。目前最安全的锂离子电池是LiFePO4电池,结构如图所示,电池中间是聚合物的隔膜,只允许Li+通过。
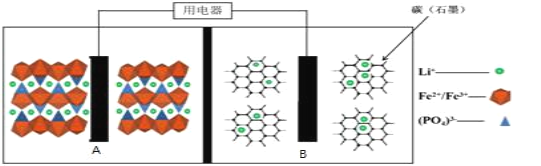
原理如下:(1-x)LiFePO4+xFePO4+LixCn![]() LiFePO4+nC。
LiFePO4+nC。
下列说法不正确的是( )
A.放电时,B电极发生氧化反应
B.放电时,导线转移1mol电子,B电极室质量减少7xg
C.充电时,A极电极反应式:xLiFePO4-xe-=xFePO4+xLi+
D.充电时,Li+从A电极室向B电极室移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在CF3COOH水溶液中将甲烷直接转化为CH3OH的反应机理如图,下列说法正确的是
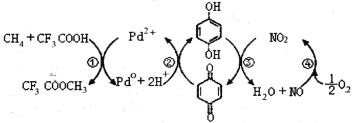
A.所含部分元素第一电离能:C<N<O<F
B.反应③的氧化剂为对苯二酚
C.此法由甲烷制取甲醇的方程式为:2CH4+O2 2CH3OH
2CH3OH
D.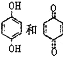 均可以与浓溴水反应,且反应类型相同
均可以与浓溴水反应,且反应类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是一种常用的还原剂,某校高三化学小组探究草酸被氧化的速率问题。
实验Ⅰ | 试剂 | 混合后 溶液pH | 现象 (1 h后溶液) | ||
试管 | 滴管 | ||||
| a | 4mL0.01molL-1KMnO4溶液,几滴浓H2SO4 | 2 mL0.3molL-1 H2C2O4溶液 | 2 | 褪为无色 |
b | 4mL0.01molL-1KMnO4溶液,几滴浓NaOH | 7 | 无明显变化 | ||
c | 4mL0.01molL-1K2Cr2O7溶液,几滴浓H2SO4 | 2 | 无明显变化 | ||
d | 4mL0.01molL-1K2Cr2O7溶液,几滴浓NaOH | 7 | 无明显变化 | ||
(1)H2C2O4是二元弱酸,写出H2C2O4溶于水的电离方程式:___________。
(2)实验Ⅰ试管a中KMnO4最终被还原为Mn2+,该反应的离子方程式为__________。
(3)瑛瑛和超超查阅资料,实验Ⅰ试管c中H2C2O4与K2Cr2O7溶液反应需数月时间才能完成,但加入MnO2可促进H2C2O4与K2Cr2O7的反应。依据此资料,吉吉和昊昊设计如下实验证实了这一点。
实验Ⅱ | 实验Ⅲ | 实验Ⅳ | |
实验 操作 |
|
|
|
实验 现象 | 6min后固体完全溶解,溶液橙色变浅,温度不变 | 6min后固体未溶解,溶液颜色无明显变化 | 6min后固体未溶解,溶液颜色无明显变化 |
实验Ⅳ的目的是:_______________。
(4)睿睿和萌萌对实验II继续进行探究,发现溶液中Cr2O72-浓度变化如图:

臧臧和蔡蔡认为此变化是通过两个过程实现的。
过程i:MnO2与H2C2O4反应生成了Mn2+。
过程ii:___________。
①查阅资料:溶液中Mn2+能被PbO2氧化为MnO4-。针对过程i,可采用如下方法证实:将0.0001mol MnO2加入到6mL______中,固体完全溶解;从中取出少量溶液,加入过量PbO2固体,充分反应后静置,观察到________________。
②波波和姝姝设计实验方案证实了过程ii成立,她们的实验方案如下:将2mL、0.3mol/LH2C2O4溶液与4mL0.01mol/LK2Cr2O7溶液混合,调至pH=2,加入0.0001molMnSO4固体,6分钟后现象为:______________
(5)综合以上实验可知,草酸发生氧化反应的速率与____________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸为二元弱酸:H2C2O4![]() HC2O+H+ Ka1、HC2O
HC2O+H+ Ka1、HC2O![]() C2O
C2O![]() +H+ Ka2。常温下,向某浓度的H2C2O4溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O、C2O
+H+ Ka2。常温下,向某浓度的H2C2O4溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O、C2O![]() 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )

A. Ka1=10-1.2
B. pH=2.7时溶液中:![]() =1000
=1000
C. 将相同物质的量的KHC2O4和K2C2O4固体完全溶于水便是配得pH为4.2的混合液
D. 向pH=1.2的溶液中加KOH溶液,将pH增大至4.2的过程中水的电离程度一直增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机化合物的说法错误的是
A.葡萄糖和淀粉互为同系物
B.植物油含不饱和脂肪酸甘油酯,与氢气加成后生成固态的人造脂肪
C.对三联苯(![]() )分子中在同一直线上的原子最多有8个
)分子中在同一直线上的原子最多有8个
D.分子式为C7H16的烷烃,最长碳链上有5个碳原子的同分异构体共有5种(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钒(V)及其化合物有着广泛的用途。请回答以下问题:
(1)钒在溶液中的主要聚合状态与溶液的pH关系如图1所示。V2O74-中V元素的化合价是_____,请写出溶液中VO3-转化为V2O74-的离子方程式:________________________。
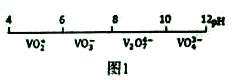
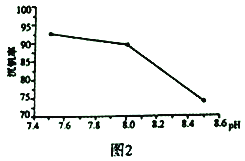
(2)“弱碱性铵盐沉钒法”原理是在含有钒元素的溶液中加入铵盐后形成NH4VO3沉淀,图2是在工业生产中不同pH环境下沉钒率的测定值。实际工业生产中常选择pH=7.5为沉钒的最佳条件,当pH超过8.0时沉钒率降低,其原因是溶液中VO3-转化为V2O74-、____________________________________。(请另写出一点原因)
(3)NH4VO3在高温下分解产生的V2O5可作为硫酸工业中2SO2(g)+O2(g) ![]() 2SO3(g) △H=p的催化剂,其催化原理如图3所示。
2SO3(g) △H=p的催化剂,其催化原理如图3所示。
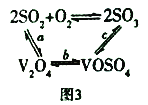
①过程a和过程b的化学方程式为:V2O5(s)+SO2(g)=V2O4(s)+SO3(g) △H = q;V2O4(s)+O2(g)+2SO2(g)=2VOSO4(s) △H = r 请写出过程c的热化学方程式:_________________。
②t2℃下,反应:2SO3(g) ![]() 2SO2(g)+O2(g)△H>0;SO3的平衡转化率(a)与体系总压强(p)的关系如图所示。
2SO2(g)+O2(g)△H>0;SO3的平衡转化率(a)与体系总压强(p)的关系如图所示。

t℃下,将2molSO3置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。B点的化学平衡常数的值是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 是一种重要的化工原料,下列有关说法错误的是( )
是一种重要的化工原料,下列有关说法错误的是( )
A.该物质的分子式为C7H8O
B.该物质属于芳香族化合物的同分异构体共有4种(不包括其本身)
C.该分子中所有碳原子共平面
D.1 mol该物质与足量的Na反应可产生11.2 L H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T℃,向体积不等的恒容密闭容器中分别加入足量活性炭和1mol NO2,发生反应:2C(s)+2NO2(g)N2(g)+2CO2(g)反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。下列说法正确的是
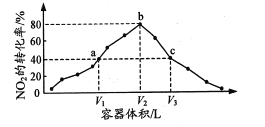
A.T℃时,该反应的化学平衡常数为![]()
B.图中c点所示条件下,v(正)>v(逆)
C.向a点平衡体系中充入一定量的NO2,达到平衡时,NO2的转化率比原平衡大
D.容器内的压强:Pa:Pb>6:7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com