
【题目】金属钒(V)及其化合物有着广泛的用途。请回答以下问题:
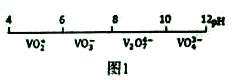
(1)钒在溶液中的主要聚合状态与溶液的pH关系如图1所示。V2O74-中V元素的化合价是_____,请写出溶液中VO3-转化为V2O74-的离子方程式:________________________。
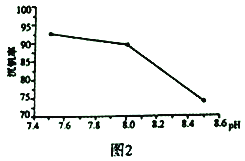
(2)“弱碱性铵盐沉钒法”原理是在含有钒元素的溶液中加入铵盐后形成NH4VO3沉淀,图2是在工业生产中不同pH环境下沉钒率的测定值。实际工业生产中常选择pH=7.5为沉钒的最佳条件,当pH超过8.0时沉钒率降低,其原因是溶液中VO3-转化为V2O74-、____________________________________。(请另写出一点原因)
(3)NH4VO3在高温下分解产生的V2O5可作为硫酸工业中2SO2(g)+O2(g) ![]() 2SO3(g) △H=p的催化剂,其催化原理如图3所示。
2SO3(g) △H=p的催化剂,其催化原理如图3所示。
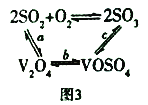
①过程a和过程b的化学方程式为:V2O5(s)+SO2(g)=V2O4(s)+SO3(g) △H = q;V2O4(s)+O2(g)+2SO2(g)=2VOSO4(s) △H = r 请写出过程c的热化学方程式:_________________。
②t2℃下,反应:2SO3(g) ![]() 2SO2(g)+O2(g)△H>0;SO3的平衡转化率(a)与体系总压强(p)的关系如图所示。
2SO2(g)+O2(g)△H>0;SO3的平衡转化率(a)与体系总压强(p)的关系如图所示。

t℃下,将2molSO3置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。B点的化学平衡常数的值是__________。
【答案】+5 2VO3-+2OH-![]() V2O74-+H2O pH过大,溶液中的NH4+会转化为NH3·H2O 2VOSO4(s)=V2O5(s)+SO3(g)+SO2(g)△H=p-q-r 0.00125
V2O74-+H2O pH过大,溶液中的NH4+会转化为NH3·H2O 2VOSO4(s)=V2O5(s)+SO3(g)+SO2(g)△H=p-q-r 0.00125
【解析】
(1)根据离子中化合价代数和等于离子所带电荷计算元素化合价;根据图示,在碱性溶液中VO3-转化为V2O74-;(2)当pH超过8.0时,溶液中VO3-转化为V2O74-、溶液中的NH4+会转化为NH3·H2O,所以导致沉钒率降低;(3)①根据盖斯定律计算过程c的热化学方程;②利用“三段式”计算平衡常数
(1)设V2O74-中V元素的化合价是x,则2x+(-2)![]() 7=-4,x=+5,所以V2O74-中V元素的化合价是+5;根据图示,在碱性溶液中VO3-转化为V2O74-,转化的离子方程式是2VO3-+2OH-
7=-4,x=+5,所以V2O74-中V元素的化合价是+5;根据图示,在碱性溶液中VO3-转化为V2O74-,转化的离子方程式是2VO3-+2OH-![]() V2O74-+H2O,故答案为:+5,2VO3-+2OH-
V2O74-+H2O,故答案为:+5,2VO3-+2OH-![]() V2O74-+H2O;
V2O74-+H2O;
(2)当pH超过8.0时,溶液中VO3-转化为V2O74-、溶液中的NH4+会转化为NH3·H2O,所以导致沉钒率降低,故答案为:pH过大,溶液中的NH4+会转化为NH3·H2O;
(3)①已知①2SO2(g)+O2(g)![]() 2SO3(g)△H=p
2SO3(g)△H=p
②V2O5(s)+SO2(g)=V2O4(s)+SO3(g)△H=q
③V2O4(s)+O2(g)+2SO2(g)=2VOSO4(g)△H=r
根据盖斯定律,①-②-③得2VOSO4(s)=V2O5(s)+SO3(g)+SO2(g)△H=p-q-r,故答案为:2VOSO4(s)=V2O5(s)+SO3(g)+SO2(g)△H=p-q-r;
根据A点得

A点的平衡常数![]() ,A、B温度相同、平衡常数相同,所以B点的平衡常数是0.00125,故答案为:0.00125。
,A、B温度相同、平衡常数相同,所以B点的平衡常数是0.00125,故答案为:0.00125。


科目:高中化学 来源: 题型:
【题目】废水对自然环境有严重的破坏作用,水污染治理刻不容缓,BMO(Bi2MoO6)是一种高效光催化剂,可用于光催化降解苯酚,原理如图所示。下列说法不正确的是( )

A.该过程中O2-e-=O2-
B.①和②中BMO+和O-都表现较强氧化性
C.催化剂BMO能降低反应的反应热和活化能
D.该过程为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活污水中的氮和磷主要以铵盐和磷酸盐形式存在,可用电解法从溶液中去除。电解装置如图:以铁作阴极、石墨作阳极,可进行除氮;翻转电源正负极,以铁作阳极、石墨作阴极,可进行除磷。
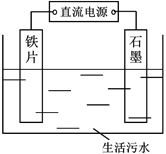
I.电解除氮
(1)在碱性溶液中,NH3能直接在电极放电,转化为N2,相应的电极反应式为:_______。
(2)有Cl-存在时,除氮原理如图1所示,主要依靠有效氯(HClO、ClO-)将NH4+ 或NH3氧化为N2。在不同pH条件下进行电解时,氮的去除率和水中有效氯浓度如图2:
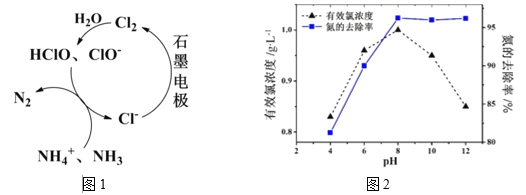
①当pH<8时,主要发生HClO氧化NH4+ 的反应,其离子方程式为:____________。
②结合平衡移动原理解释,当pH<8时,氮的去除率随pH的降低而下降的原因是:_____。
③当pH>8时,ClO-发生歧化导致有效氯浓度下降,而氮的去除率却并未明显下降,可能的原因是(答出一点即可):______。
II.电解除磷
(3)除磷的原理是利用Fe2+ 将PO43- 转化为Fe3(PO4)2沉淀。
①用化学用语表示产生Fe2+的主要过程:_______________。
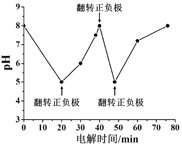
②如图为某含Cl- 污水在氮磷联合脱除过程中溶液pH的变化。推测在20-40 min时脱除的元素是________。
(4)测定污水磷含量的方法如下:取100mL污水,调节至合适pH后用AgNO3溶液使磷全部转化为Ag3PO4沉淀。将沉淀过滤并洗涤后,用硝酸溶解,再使用NH4SCN溶液滴定产生的Ag+,发生反应Ag++SCN-=AgSCN↓,共消耗c mol/LNH4SCN溶液V mL。则此污水中磷的含量为___mg/L(以磷元素计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气和燃煤尾气是造成雾霾的主要原因之一。
(1)工业上利用甲烷催化还原NO,可减少氮氧化物的排放。
已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ·mol1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH =-1160kJ·mol1
甲烷直接将NO2还原为N2的热化学方程式为____________________________。
(2)减少汽车尾气污染的原理为2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH <0。向恒温恒容密闭容器中充入NO和CO,用传感器测得的数据如下表所示:
N2(g)+2CO2(g) ΔH <0。向恒温恒容密闭容器中充入NO和CO,用传感器测得的数据如下表所示:
时间/s | 0 | 1 | 2 | 3 | 4 |
c(NO)/×10-3mol·L1 | 9.00 | 4.00 | 2.00 | 1.00 | 1.00 |
c(CO)/×10-3mol·L1 | 9.00 | 4.00 | 2.00 | 1.00 | 1.00 |
①为了提高尾气处理的效果,可采取的措施有____________(写出两种即可)。
②此条件下达到平衡时,计算该反应的平衡常数K=____________________。
(3)工业上用氢氧化钠溶液来同时吸收SO2和氮的氧化物气体(NOx),可得到Na2SO3、NaHSO3、NaNO2、NaNO3等溶液。(已知:常温下,HNO2的电离常数为Ka=7×10-4,H2SO3的电离常数为Ka1=1.2×10-2、Ka2=5.8×10-8)。
①常温下,相同浓度的Na2SO3、NaNO2溶液中pH较大的是________溶液。
②常温下,NaHSO3显_________性(填“酸”“碱”或“中”),判断的理由是________________________________________________(通过计算说明)。
(4)铈素(Ce)常见有+3、+4两种价态。NO可以被含Ce4+的溶液吸收,生成NO2-、NO3-(二者物质的量之比为1∶1)。可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如图所示。

①Ce4+从电解槽的__________(填字母代号)口流出。
②写出阴极的电极反应式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅氧化还原液流电池是一种新型储能电池。该电池以酸性甲基磺酸铅溶液为电解液,简化的工作原理如图所示,下列说法正确的是
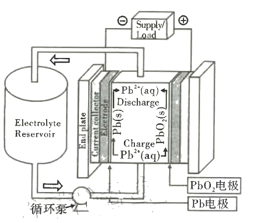
A.放电时,H+经过循环泵向Pb电极移动
B.放电时,负极反应式为Pb-2e- +SO42- = PbSO4
C.充电时,电解液中H+、Pb2+的物质的量浓度均减小
D.充电时,阳极反应式为Pb2+ +2H2O-2e- = PbO2 +4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,下列说法中不正确的是( )
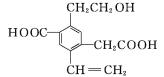
A.1 mol该有机物和过量的金属钠反应最多可以生成1.5 mol H2
B.该有机物最多消耗Na、NaOH、NaHCO3的物质的量之比为3∶2∶2
C.可以用酸性KMnO4溶液检验其中的碳碳双键
D.该有机物能够在催化剂作用下发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是

A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醚是一种用途很广的化工产品,毒性和危险性小,是安全性很高的有机溶剂,对许多天然及合成油脂、树脂、橡胶、有机酸酯、生物碱等都有很强的溶解能力,还可作为电子级清洗剂和多种有机合成材料。可通过以下反应原理制取正丁醚:
2CH3CH2CH2CH2OH![]() CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
己知相关物质的部分信息如下:
沸点(℃) | 密度(g/cm3) | 溶解度(g) | 相对分子质量 | |
正丁醇 | 117.7 | 0.81 | 7.9 | 74 |
正丁醚 | 142 | 0.77 | 不溶于水 | 130 |
某课外化学学习小组查阅相关资料设计了以下实验步骤合成正丁醚:
①在100 mL两口烧瓶中加入30.0 mL正丁醇、5.0 mL浓硫酸和几粒沸石,充分摇匀。在分水器中加入3.0 mL饱和食盐水,按图甲组装仪器,接通冷凝水;
②反应:在电热套上加热,使瓶内液体微沸,回流反应约1小时。当馏液充满分水器时,打开分水器放出一部分水。当水层不再变化,瓶中反应温度达150 ℃,反应己基本完成,停止加热;
③蒸馏:待反应液冷却后,拆下分水器,将仪器改成蒸馏装置如图丙,再加几粒沸石,蒸馏,收集馏分;
④精制:将馏出液倒入盛有10 mL水的分液漏斗中,充分振摇,静置弃去水液,有机层依次用5 mL水,3 mL 5% NaOH溶液、3 mL水和3 mL饱和氯化钙溶液洗涤,分去水层,将产物放入洁净干燥的小锥形瓶中,然后加入0.2~0.4 9无水氯化钙,再将液体转入装置丙中进行蒸馏,收集到馏分9.0 mL。
甲. 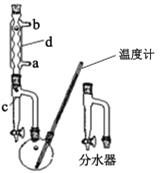 乙.
乙. ![]() 丙.
丙.
请根据以上操作回答下列问题:
(1)制备正丁醚的反应类型是___,仪器d的名称是____。
(2)在步骤①中添加试剂的顺序是____。相比装置乙,装置甲的优点是 ___。
(3)在步骤②中采用电热套加热而不采用酒精灯直接加热的原因可能是____。
(4)在步骤③中收集馏分适宜的温度范围为____(填正确答案标号)。
A.115℃~ll9℃ B.140℃~144℃ C. 148℃~152℃
(5)在精制中,有机层在____层(填“上”或“下”),加入无水氯化钙的作用是____。
(6)本小组实验后所得正丁醚的产率约为 ___%(计算结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z-离子的电子数之差为8,下列说法不正确的是 ( )
A. 与W相邻的同主族元素可制成重要的半导体材料
B. X单质不可能置换出W单质
C. 元素原子半径从大到小的顺序是X、Y、Z
D. W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是HZO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com