
【题目】已知草酸为二元弱酸:H2C2O4![]() HC2O+H+ Ka1、HC2O
HC2O+H+ Ka1、HC2O![]() C2O
C2O![]() +H+ Ka2。常温下,向某浓度的H2C2O4溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O、C2O
+H+ Ka2。常温下,向某浓度的H2C2O4溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O、C2O![]() 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )

A. Ka1=10-1.2
B. pH=2.7时溶液中:![]() =1000
=1000
C. 将相同物质的量的KHC2O4和K2C2O4固体完全溶于水便是配得pH为4.2的混合液
D. 向pH=1.2的溶液中加KOH溶液,将pH增大至4.2的过程中水的电离程度一直增大
【答案】C
【解析】A.由图象计算Ka1由电离常数可以知道Ka1=![]()
B. 由图象计算Ka1、Ka2,由电离常数可以知道![]() =
=![]() ;
;
C. KHC2O4和K2C2O4的物质的量相同,但如配成不同浓度的溶液,则pH不一定为4.2;
D.向pH=1.2的溶液中加KOH溶液将pH增大至4.2,溶液氢离子浓度减小,对水的电离抑制的程度减小。
A.由图象可以知道pH=1.2时,c(HC2O)=c(H2C2O4),则Ka1=c(H+)=10-1.2,所以A选项是正确的;
B. 由图象可以知道pH=1.2时,c(HC2O)=c(H2C2O4),则Ka1=c(H+)=10-1.2,pH=4.2时,c(HC2O)=c(C2O42-),则Ka2=c(H+)=10-4.2,
由电离常数可以知道![]() =
=![]() =
=![]() =103=1000,所以B选项是正确的;
=103=1000,所以B选项是正确的;
C.将相同物质的量KHC2O4和K2C2O4固体完全溶于水,可配成不同浓度的溶液,溶液浓度不同,pH不一定为定值,即不一定为4.2,故C错误;
D.向pH=1.2的溶液中加KOH溶液将pH增大至4.2,溶液中由酸电离的氢离子浓度减小,则对水的电离抑制的程度减小,水的电离度一直增大,所以D选项是正确的。
故本题答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】原电池是化学对人类的一项重大贡献。
(1)某兴趣小组为研究电池原理,设计如图A装置。
|
|
A | B |
①a和b不连接时,烧杯中发生反应的离子方程式是___________________。
②a和b用导线连接,Cu极为原电池________(填“正”或“负”)极,该电极反应式是____________________________。
③无论a和b是否连接,Zn片均被腐蚀,若转移了0.4 mol电子,则理论上Zn片质量减轻________ g。
(2)如图B是甲烷燃料电池原理示意图,回答下列问题:
①电池的负极是________(填“a”或“b”)电极,该极的电极反应式为________________。
②电池工作一段时间后电解质溶液的pH________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物H ( )是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:
)是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:

已知:①C、D、G均为芳香族化合物,分子中均只含两种不同化学环境的氢原子。
②Diels-Alder反应:![]() 。
。
(1)生成A的反应类型是_______。D的名称是_______。F中所含官能团的名称是_______。
(2)B的结构简式是_______;“B→C”的反应中,除C外,另外一种产物是_______。
(3)D+G→H的化学方程式是______。
(4)Q是D的同系物,相对分子质量比D大14,则Q可能的结构有______种,其中核磁共振氢谱有4组峰,且峰面积比为1:2:2:3的结构简式为______(任写一种)。
(5)已知:乙炔与1,3-丁二烯也能发生Diels-Alder反应。请以1,3-丁二烯和乙炔为原料,选用必要的无机试剂合成 ,写出合成路线__________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
,写出合成路线__________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中表示碳原子相互结合的几种方式。小圆球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢原子结合,则下列说法正确的是
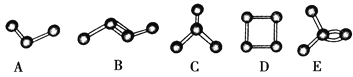
A. 图中属于烷烃的是A、C、D
B. 图中C和E分子中氢原子数相同
C. 图中物质碳元素的质量分数最小的是A
D. 图中与B互为同分异构体的有C、D、E
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,金属硫化物的沉淀溶解平衡曲线如图所示。纵坐标p(Mn+)表示-lgc(Mn+),横坐标p(S2-)表示-lgc(S2-),下列说法不正确的是( )
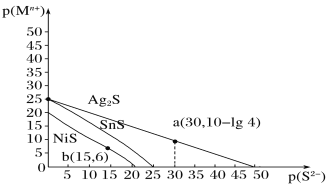
A. 该温度下,Ag2S的Ksp=1.6×10-49
B. 该温度下,溶解度的大小顺序为NiS>SnS
C. SnS和NiS的饱和溶液中![]() =104
=104
D. 向含有等物质的量浓度的Ag+、Ni2+、Sn2+溶液中加入饱和Na2S溶液,析出沉淀的先后顺序为Ag2S、SnS、NiS
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关过氧化氢的叙述正确的是( )
A. 过氧化氢是离子化合物
B. 过氧化氢分子只含有极性键
C. 过氧化氢分子只含有非极性键
D. 过氧化氢分子既含有非极性键又含有极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.乙烯的化学性质比乙烷活泼
B.乙烯燃烧时火焰明亮,同时产生黑烟
C.乙烯的结构简式为CH2=CH2
D.乙烯双键中的一个键可以断裂,容易发生加成反应和取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是基础化工的重要产品,工业上制备硫酸的主要反应为:
造气: 4 FeS2 +11O2 ![]() 2 Fe2O3+ 8 SO2
2 Fe2O3+ 8 SO2
催化氧化: 2 SO2 + O2 ![]() 2 SO3
2 SO3
吸收: SO3 + H2O → H2SO4
完成下列填空:
(1)一定条件下,1 mol SO2和0.75 mol O2在容积为1 L的恒容密闭容器中发生反应,5 min时达到化学平衡。
①反应达到平衡后若改变条件使平衡常数K值变大,则在平衡移动过程中υ(正) _______(填序号)
a.一直增大 b.一直减小 c.先增大后减小 d.先减小后增大
②达到平衡时若SO3的浓度为0.98 mol·L-1,则5min内氧气的反应速率为_________ mol·L-1·min-1。反应体系中氧气过量的目的是_____________________。
(2)催化氧化反应中,SO2的平衡转化率与温度、压强的关系如图所示。则工业生产中最适宜的压强为___________,最适宜的温度范围为___________。

(3)若制取硫酸的上述三个反应过程中硫元素的转化率都是98%, 则1 mol硫铁矿可以制得SO2____________L(标准状况下),最终得到纯硫酸______________mol(均保留2位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答下列问题。该小组设计的简单实验装置如图所示,该实验的主要操作步骤如下:
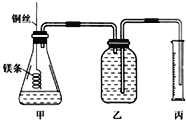
配制100ml1.0mol·L-1的盐酸溶液,用______(填仪器名称并注明规格)量取10.0ml1.0mol/L的盐酸溶液加入锥形瓶中;用托盘天平称取ag已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为_________;往广口瓶中装入足量水,按如图连接好装置,检查装置的气密性;反应结束后待体系温度恢复到室温,读出量筒中水的体积为VmL。
(1)请将上述步骤补充完整。
(2)用文字表述实验步骤④中检查装置气密性的方法:__________________________。
(3)实验步骤⑤中应选用_________(填序号)的量筒。
A.100ml B.200ml C.500ml
(4)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积Vm=_____________,若未除去镁条表面的氧化膜,则测量结果___________________(填“偏大”、“偏小”或“无影响”)。
(5)若在配制盐酸过程中出现下列情况,将使所配制的溶液的浓度偏高的是___________(填各选项的序号)。
a.配制溶液所用的容量瓶洗净后没有烘干
b.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
c.最后确定HCl溶液体积(定容)时,俯视观察液面与容量瓶刻度线
d.定容摇匀后静置,发现液面低于刻度线,再加蒸馏水至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com