
【题目】常温下,![]() 先将
先将![]() 溶于水制成
溶于水制成![]() 溶液,然后取出
溶液,然后取出![]() 溶液滴加
溶液滴加![]() 溶液,整个过程中利用
溶液,整个过程中利用![]() 数据采集器测得溶液的
数据采集器测得溶液的![]() 变化曲线如图所示(实验过程中不考虑
变化曲线如图所示(实验过程中不考虑![]() 的挥发和
的挥发和![]() 的分解)。下列说法正确的是
的分解)。下列说法正确的是
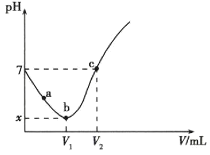
A.![]() 过程中,是氯气溶于水的过程,
过程中,是氯气溶于水的过程,![]() 和水的电离程度均不断增大
和水的电离程度均不断增大
B.![]() 点溶液中
点溶液中![]() 接近于
接近于![]()
C.![]() ,溶液中
,溶液中![]()
D.滴加![]() 溶液的体积为
溶液的体积为![]() 时,
时,![]()
【答案】C
【解析】
常温下,纯水的pH=7,题图曲线的起点为纯水,从起点至b点为将Cl2通入水中得到氯水的过程,此过程中发生反应Cl2+H2OH++Cl-+HClO;b点往后为向氯水中滴加NaOH溶液的过程,此过程中发生反应Cl2+2NaOH=NaCl+NaClO+H2O,100mL溶液中溶解了0.01mol×![]() =0.001mol,根据反应Cl2+2NaOH=NaCl+NaClO+H2O,Cl2与NaOH完全反应时消耗NaOH溶液的体积为0.002mol÷0.1mol/L=20mL,此时溶液中溶质为NaCl和NaClO,由于ClO-的水解溶液呈碱性。
=0.001mol,根据反应Cl2+2NaOH=NaCl+NaClO+H2O,Cl2与NaOH完全反应时消耗NaOH溶液的体积为0.002mol÷0.1mol/L=20mL,此时溶液中溶质为NaCl和NaClO,由于ClO-的水解溶液呈碱性。
A. Cl2与水的反应为Cl2+H2O![]() H++C1-+HClO,由题图可知a~b过程中,pH不断减小,c(H+)不断增大,酸性越强,对水的电离抑制程度增大,则水的电离程度不断减小,A错误;
H++C1-+HClO,由题图可知a~b过程中,pH不断减小,c(H+)不断增大,酸性越强,对水的电离抑制程度增大,则水的电离程度不断减小,A错误;
B.根据反应Cl2+H2OH++Cl-+HClO,若0.01molCl2溶于水时与水完全反应,则生成0.01molHCl和0.01molHClO,HCl完全电离、HClO部分电离,溶液中c(H+)略大于0.01mol/L,溶液的pH略小于2,c(HClO) ≈10-2mol/L,根据![]() 和c(H+)=10-xmol/L得出
和c(H+)=10-xmol/L得出![]() ,但0.0lmoCl2溶于水时只有部分Cl2与水反应,故溶液中c(H+)<0.01mol/L,溶液的pH>2,生成的n(HClO)<0.01mol,溶液中c(HClO)<0.01mol/L,故c(ClO-)比
,但0.0lmoCl2溶于水时只有部分Cl2与水反应,故溶液中c(H+)<0.01mol/L,溶液的pH>2,生成的n(HClO)<0.01mol,溶液中c(HClO)<0.01mol/L,故c(ClO-)比![]() 小,B错误;
小,B错误;
C. c点溶液pH=7,根据分析,c点加入的NaOH溶液的体积小于20mL,即V2-V1<20,此时溶液中的电荷守恒为c(Na+)+c(H+)=c(Cl-)+c(ClO-)+c(OH-),因c(H+)=c(OH-),则c(Na+)=c(Cl-)+c(ClO-),根据反应中的得失电子守恒和物料守恒,c(Cl-)=c(ClO-)+c(HClO),将两式整理得c(Na+)=2c(ClO-)+c(HClO),C正确;
D. 根据分析,加入NaOH溶液的体积为20mL时,Cl2与NaOH恰好完全反应,得到含等物质的量浓度的NaCl和NaClO的混合液,溶液中的物料守恒为c(Na+)=c(Cl-)+c(ClO-)+c(HClO),D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,回答下列问题:
(1)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
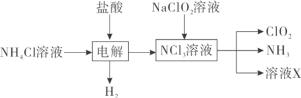
①电解时阳极电极反应式为__________________________。
②除去ClO2中的NH3可选用的试剂是___________(填标号)。
a.水 b.碱石灰 c.浓硫酸 d.饱和食盐水
(2)用如图装置可以测定混合气中ClO2的含量:
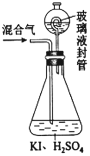
Ⅰ.在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入3mL稀硫酸:
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中:
Ⅴ.用0.1000mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去20.00mL硫代硫酸钠溶液。在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为______________________。
②玻璃液封装置的作用是______________________。
③V中加入指示剂,滴定至终点的现象是______________________。
④测得混合气中ClO2的质量为______g。
⑤某同学用某部分刻度模糊不清的50mL滴定管进行实验,当滴定管中的液面处于如图所示的刻度处,则管内液体的体积________(填代号)。
a.等于23.60mL b.等于27.60mL c.小于23.60mL d.大于27.60mL
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20 mL某浓度的AlCl3溶液中滴加2 mol·L-1的NaOH溶液时,得到Al(OH)3沉淀的质量(g)与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
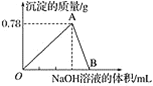
(1)图中A点表示的沉淀是__________(写化学式),其物质的量为____________。
(2)反应至A点时消耗NaOH溶液的体积为______________。
(3)图中B点溶液中的溶质有________________。
(4)AlCl3溶液的浓度为______________。
(5)O点到B点反应的总离子方程式可表示为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯二氧化碳主要用于医学研究及临床诊断及电子工业;含碳的有机物醇、醛在生产生活中有广泛运用。
I.(1)工业上用CO2和H2在一定条件下反应可合成二甲醚,已知:
2CO2(g)+6H2(g)=2CH3OH(g)+2H2O(g) △H1=-107.4kJ/mol
2CH3OH(g)=CH3OCH3(g)+H2O(g) △H2=-23.4kJ/mol
则2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3=________kJ/mol
CH3OCH3(g)+3H2O(g) △H3=________kJ/mol
(2)在一定条件下将CO2和H2充入一固定容积的密闭容器中,在两种不同温度下发生反应:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g),测得CH3OCH3(g)的物质的量随时间的变化如图所示。
CH3OCH3(g)+3H2O(g),测得CH3OCH3(g)的物质的量随时间的变化如图所示。
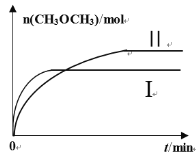
①曲线I、Ⅱ对应的平衡常数大小关系为KI_______KⅡ(填“>”“=”或“<”)。
②一定温度下,下列能判断该反应达到化学平衡状态的是________(填序号)。
a.混合气体密度不变
b.二甲醚和水蒸气的反应速率之比保持不变
c.v正(H2)=2v逆(H2O)
d.2个C=O断裂的同时有3个H-O断裂
(3)合成气CO和H2在一定条件下能发生如下反应:CO(g)+2H2(g)![]() CH3OH(g) △H。在某压强下,合成甲醇的反应在不同温度、不同投料比时,CO的转化率如图所示。
CH3OH(g) △H。在某压强下,合成甲醇的反应在不同温度、不同投料比时,CO的转化率如图所示。
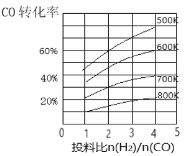
①600K温度下,将1molCO和4molH2充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(H2)=___________。
②若投料比保持不变,升高温度,该反应平衡向_______方向移动(填“正反应”或“逆反应”)。
③上述合成甲醇的过程中提高CO的转化率可采取的措施有______。(列举一种即可)。
Ⅱ.用隔膜电解法处理高浓度乙醛废水的原理为:
使用惰性电极电解,乙醛分别在阴、阳极转化为乙醇和乙酸,总反应为:2CH3CHO+H2O![]() CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程。
CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程。
①电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极产生气体的电极反应为:______。
②在实际工艺处理过程中,阴极区乙醛的去除率可达80%。若在两极区分别注入1m3乙醛含量为400mg/L的废水,可得到乙醇________kg(计算结果保留2位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图实验装置进行相关实验,能得出相应实验结论的是( )
a | b | c | 实验结论 |
| |
A | 浓醋酸 | CaCO3 | C6H5ONa溶液 | 酸性:碳酸>苯酚 | |
B | Br2的苯溶液 | 铁屑 | AgNO3溶液 | 苯和液溴发生取代反应 | |
C | 浓盐酸 | 酸性KMnO4溶液 | 碘化钾溶液 | 氧化性:Cl2>I2 | |
D | 饱和食盐水 | 电石 | 酸性KMnO4溶液 | 乙炔具有还原性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。
(I)汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:![]()
![]()
![]()
![]()
若某反应的平衡常数表达式为![]() ,则此反应的热化学方程式为_______。
,则此反应的热化学方程式为_______。
(2)![]() 在一定条件下可发生分解:
在一定条件下可发生分解:![]() ,一定温度下,在恒容密闭容器中充入一定量
,一定温度下,在恒容密闭容器中充入一定量![]() 进行该反应,能判断反应已达到化学平衡状态的是_____(填字母)。
进行该反应,能判断反应已达到化学平衡状态的是_____(填字母)。
a. ![]() 和
和![]() 的浓度比保持不变 b.容器中压强不再变化
的浓度比保持不变 b.容器中压强不再变化
c. ![]() d. 气体的密度保持不变
d. 气体的密度保持不变
(Ⅱ)甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。 CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
(3)将![]() 和
和![]() 按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应生成
按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应生成![]() ,如图1表示压强为0.1 MPa和5.0 MPa下
,如图1表示压强为0.1 MPa和5.0 MPa下![]() 转化率随温度的变化关系。
转化率随温度的变化关系。
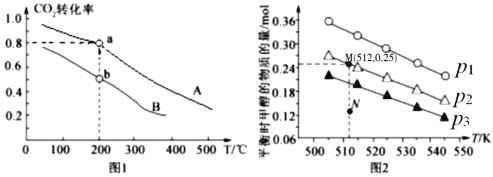
①a、b两点化学反应速率分别用![]() ,表示,则
,表示,则![]() _____
_____![]() (填“大于”、“小于”或“等于”)
(填“大于”、“小于”或“等于”)
②列出a点对应的平衡常数表达式K= ____________________。
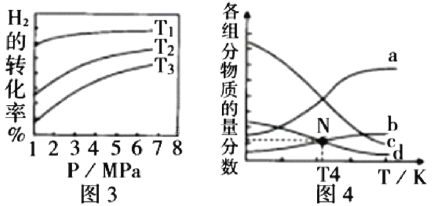
(4)在1.0 L恒容密闭容器中投入1 mol ![]() 和2.75 mol
和2.75 mol ![]() 发生反应:
发生反应:![]() CH3OH(g) + H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是________。
CH3OH(g) + H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是________。
A.该反应的正反应为放热反应
B.压强大小关系为P1<P2<P3
C.M点对应的平衡常数K的值约为![]()
D.在![]() 及512 K时,图中N点
及512 K时,图中N点![]()
(5)![]() 催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)
催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g) ![]() C2H5OH(g) + 3H2O(g)
C2H5OH(g) + 3H2O(g) ![]() ;m代表起始时的投料比,即
;m代表起始时的投料比,即![]() 。
。
① 图3中投料比相同,温度![]() ,则该反应的焓变
,则该反应的焓变![]() _______0(填
_______0(填![]() )。
)。
② m=3时,恒压条件下各物质的物质的量分数与温度的关系如图4所示,则曲线b代表的物质为_________(填化学式)。
(6)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图5所示。离子交换膜a为 ______(填“阳膜”、“阴膜”),阳极的电极反应式为_______________________________________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:

(1)装置A的分液漏斗中盛装的试剂是______,烧瓶中发生的反应的化学方程式是________。
(2)画出虚线框内的实验装置图,所加试剂为____________,该装置的作用是_______。
(3)装置B中盛放的试剂是____________(填序号),实验现象为____________,该反应的离子方程式是_____________,该反应属于四种基本反应类型中的__________反应。
A Na2S溶液 B Na2SO3溶液 C Na2SO4溶液
(4)已知:①硫酸比次氯酸稳定;②高氯酸的酸性比硫酸强;③S2-比Cl-易被氧化;④HCl比H2S稳定;⑤铜与盐酸不反应,但能与浓硫酸反应;⑥铁与氯气在加热条件下反应生成三氯化铁,铁与硫在加热条件下反应生成硫化亚铁;⑦硫原子与氯原子的电子层数相同,氯的原子半径小于硫原子。能说明氯的非金属性比硫强的是________(填序号)。
A 全部 B ②③④⑥⑦ C ①②④⑤⑥ D ②③④⑤⑥⑦
(5)装置C中盛放烧碱溶液,目地是吸收反应后剩余的气体,防止污染空气,写出该装置中所发生反应的离子方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备纯碱的主要步骤如流程所示:

四种盐在不同温度下的溶解度(g/100gH2O)表
温度 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
提示:温度高于35℃时NH4HCO3会分解,请回答:
(1)下列操作或描述正确的是________。
A.温度控制在30-35℃是因为温度太高NH4HCO3会分解,温度太低反应速率太慢
B.保温30min的目的是使反应充分进行
C.过滤后的滤液只有NH4Cl和NH4HCO3溶质
D.洗去晶体表面的杂质可以选用蒸馏水
(2)反应温度控制在30~35℃,为控制此温度范围,采取的加热方法为______________。
(3)常温时,过滤后主要得到NaHCO3晶体的原因是______________。
(4)灼烧NaHCO3晶体的装置为________。
A.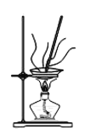 B.
B.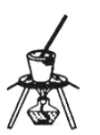 C.
C.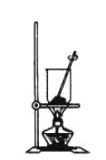
(5)洗涤NaHCO3晶体的操作______________。
(6)测定纯碱产品中NaHCO3含量的方法:准确称取纯碱样品Wg放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用物质的量浓度为c(mol·L-1)的HCl溶液滴定至溶液由红色到无色(指示CO32-+H+=HCO3-反应的终点)所用HCl溶液体积为V1mL。再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液体积为V2mL,写出纯碱样品中NaHCO3质量分数的计算式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CuO高温灼烧生成Cu2O,Cu2O与稀H2SO4反应的离子方程式为:Cu2O+2H+═Cu+Cu2++H2O。现将经高温灼烧后的CuO样品投入足量稀硫酸中得到混合溶液,有关说法正确的是( )
A.反应中Cu2O只作氧化剂
B.若有28.8g Cu2O参加反应,则转移电子数为0.2NA
C.Cu2O的稳定性比CuO弱
D.如果溶液中出现蓝色,说明CuO已分解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com