
【题目】实验室制备纯碱的主要步骤如流程所示:

四种盐在不同温度下的溶解度(g/100gH2O)表
温度 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
提示:温度高于35℃时NH4HCO3会分解,请回答:
(1)下列操作或描述正确的是________。
A.温度控制在30-35℃是因为温度太高NH4HCO3会分解,温度太低反应速率太慢
B.保温30min的目的是使反应充分进行
C.过滤后的滤液只有NH4Cl和NH4HCO3溶质
D.洗去晶体表面的杂质可以选用蒸馏水
(2)反应温度控制在30~35℃,为控制此温度范围,采取的加热方法为______________。
(3)常温时,过滤后主要得到NaHCO3晶体的原因是______________。
(4)灼烧NaHCO3晶体的装置为________。
A.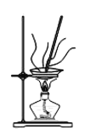 B.
B.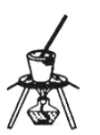 C.
C.
(5)洗涤NaHCO3晶体的操作______________。
(6)测定纯碱产品中NaHCO3含量的方法:准确称取纯碱样品Wg放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用物质的量浓度为c(mol·L-1)的HCl溶液滴定至溶液由红色到无色(指示CO32-+H+=HCO3-反应的终点)所用HCl溶液体积为V1mL。再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液体积为V2mL,写出纯碱样品中NaHCO3质量分数的计算式:______________。
【答案】ABD 水浴加热 因为在所有反应物和生成物中,碳酸氢钠在该温度下的溶解度最小 B 向碳酸氢钠晶体中加入蒸馏水浸没晶体,使蒸馏水慢慢流下,重复2~3次 ![]() ×100%
×100%
【解析】
(1)A.温度控制在30~35℃是因为温度太高NH4HCO3会分解,温度太低反应速率太慢,故A正确;
B.保温30min的目的是使反应充分进行,故B正确;
C.过滤后的滤液有NH4Cl、NH4HCO3、NaCl、NaHCO3溶质,故C错误;
D.洗去晶体表面的杂质操作为:向碳酸氢钠晶体中加入蒸馏水浸没晶体,使蒸馏水慢慢流下,重复2~3次,可以用蒸馏水,故D正确;故答案选:ABD;
(2)反应温度控制在30~35℃,需采用水浴加热法,故答案为:水浴加热;
(3)通过表格中溶解度分析常温时, NaHCO3溶解度最小,故过滤后主要得到NaHCO3晶体,故答案为:因为在所有反应物和生成物中,碳酸氢钠在该温度下的溶解度最小;
(4)灼烧晶体应在坩埚中进行,A为蒸发皿,B为坩埚,C为烧杯,故答案选:B;
(5)洗涤NaHCO3晶体的操作为向碳酸氢钠晶体中加入蒸馏水浸没晶体,使蒸馏水慢慢流下,重复2~3次,故答案为:向碳酸氢钠晶体中加入蒸馏水浸没晶体,使蒸馏水慢慢流下,重复2~3次;
(6)样品中与碳酸氢钠反应消耗盐酸的物质的量![]() mol,根据离子方程式HCO3-+H+=CO2↑+H2O可知NaHCO3物质的量
mol,根据离子方程式HCO3-+H+=CO2↑+H2O可知NaHCO3物质的量![]() mol,则NaHCO3的质量
mol,则NaHCO3的质量![]() g,纯碱样品中NaHCO3质量分数为
g,纯碱样品中NaHCO3质量分数为![]() ×100%,故答案为:
×100%,故答案为:![]() ×100%。
×100%。


科目:高中化学 来源: 题型:
【题目】(1)我国是激光技术先进的国家,红宝石(Al2O3)是最早用于产生激光的材料。请用离子方程式来证明它是一种两性氧化物:____________、___________.
(2)取等质量的两份某镁铝合金分别加入足量的稀盐酸和氢氧化钠溶液中,产生的标准状况下H2体积分别为33.6L、22.4L则该合金中镁、铝的物质的量之比为___________。
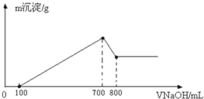
(3)将一定质量的镁铝合金溶解在500mL盐酸中,向反应后的溶液中逐滴加入2mol/LNaOH溶液,产生沉淀质量与碱溶液体积的关系如图所示.则盐酸的物质的量浓度(假设反应前后溶液体积的变化忽略不计)_______________.产生沉淀质量的最大值_____________g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,![]() 先将
先将![]() 溶于水制成
溶于水制成![]() 溶液,然后取出
溶液,然后取出![]() 溶液滴加
溶液滴加![]() 溶液,整个过程中利用
溶液,整个过程中利用![]() 数据采集器测得溶液的
数据采集器测得溶液的![]() 变化曲线如图所示(实验过程中不考虑
变化曲线如图所示(实验过程中不考虑![]() 的挥发和
的挥发和![]() 的分解)。下列说法正确的是
的分解)。下列说法正确的是
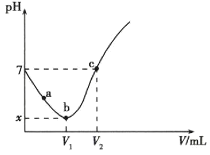
A.![]() 过程中,是氯气溶于水的过程,
过程中,是氯气溶于水的过程,![]() 和水的电离程度均不断增大
和水的电离程度均不断增大
B.![]() 点溶液中
点溶液中![]() 接近于
接近于![]()
C.![]() ,溶液中
,溶液中![]()
D.滴加![]() 溶液的体积为
溶液的体积为![]() 时,
时,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含碘废液(含有CCl4、I2、I-等)中回收碘,向废液中加入Na2SO3溶液反应后进行分离除去CCl4,再向反应液中通入Cl2进行氧化、富集等系列操作获得碘单质。下列说法不正确的是:
A.加入Na2SO3溶液发生的氧化还原反应为:SO32-+I2+H2O=SO42-+2I-+2H+
B.氧化时应控制在较低温度(40℃左右),可增大Cl2的溶解度并减少I2的损失
C.分离除去CCl4的操作为萃取,应在分液漏斗中进行
D.工业上常在干海带浸泡液中通入适量氯气,再采用过滤的方法得到粗碘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某研究性学习小组用粗铜(含杂质Fe)与过量氯气反应得到固体,用稀盐酸溶解,然后加试剂调节溶液的pH,经系列操作可得氯化铜晶体。请回答:
(1)电解精炼粗铜时,阴极发生的电极反应为__________。
(2)调节溶液pH的合适试剂为__________。
A.CuO B.Na2CO3 C.Cu2(OH)2CO3 D.稀氨水
(3)在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热后生成CuCl沉淀,写出离子方程式__________。
Ⅱ.某无机化合物A的相对分子质量为184。在一定条件下,SCl2与氨完全反应生成A和淡黄色单质B及离子化合物X,且X的水溶液的pH<7。将18.4gA隔绝空气加强热可得到12.8gB和气体单质C,单质C在标准状况下的密度为1.25g·L-1。请回答下列问题:
(4)A中所含的元素为__________(用元素符号表示)。
(5)写出A隔绝空气加强热的反应方程式__________。
(6)写出SCl2与氨反应的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2可作为能源和化工原料,应用十分广泛。工业上可利用CO或CO2与H2反应来制备甲醇。
反应①:2H2(g)+CO(g)![]() CH3OH(g)△H=-90.8kJ·mol-1
CH3OH(g)△H=-90.8kJ·mol-1
反应②:H2(g)+CO2(g)![]() H2O(g)+CO(g)△H=+41.2kJ·mol-1
H2O(g)+CO(g)△H=+41.2kJ·mol-1
(1)写出用CO2与H2反应制备甲醇的热化学方程式______________。
(2)已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)![]() H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
升高温度,该平衡的移动方向是______________(填“正向”或“逆向”)。500℃时,CO和H2O的起始浓度均为0.020mol·L-1,该条件下CO的平衡浓度为:______________mol·L-1。
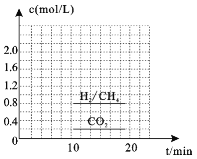
(3)一定条件下,可以由CO2(g)和H2(g)合成CH4(g),同时还生成H2O(g)。向恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,10min达到平衡时部分物质的量浓度如图所示,该温度下的的平衡常数等于_______________。
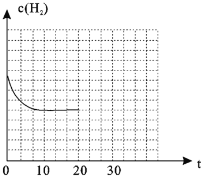
(4)若在20min时减小压强,并在30min时达到平衡状态,请在图2中画出H2的物质的量浓度随时间变化的图像__________________。
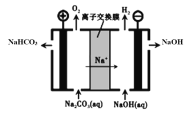
(5)工业上电解Na2CO3溶液可以生成NaHCO3和NaOH两种工业重要原料,装置如图所示。请写出阳极的电极反应式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家预测21世纪中叶将进入“氢能经济”时代,许多化合物或合金都是具有广阔应用前景的储氢材料。回答下列问题:
(1)基态Li原子核外电子有___种不同的运动状态,占据最高能层电子的电子云轮廓图形状为__。
(2)Li的焰色反应为紫红色,很多金属元素能产生焰色反应的原因为__________。
(3)亚氨基锂(Li2NH) 中所含的元素,电负性由大到小排列的顺序是_________。
(4)咔唑(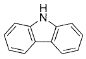 )的沸点比芴(
)的沸点比芴(![]() )高的主要原因是_______。
)高的主要原因是_______。
(5)NH3BH3 (氨硼烷,熔点104℃)与______(写出一种分子)互为等电子体。可通过红外光谱测定该分子的立体构型,NH3BH3中B的杂化轨道类型为________。
(6)一种储氢合金的晶胞结构如图所示。在晶胞中Cu原子处于面心,Au原子处于顶点位置。该晶体中,原子之间的作用力是_______。实现储氢功能时,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中心(如图),若所有四面体空隙都填满,该晶体储氢后的化学式为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作不能达到实验目的的是
A | B | C | D |
|
|
|
|
分离乙酸乙酯与饱和碳酸钠溶液 | 除去乙炔中的硫化氢 | 检验反应生成的气体中含有乙烯 | 酸性:醋酸>碳酸>硼酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关如图有机物说法正确的是
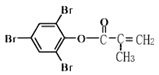
A.有机物中所有原子均在同一平面内
B.可发生的反应类型有取代、加成、还原、水解、氧化
C.1 mol 该化合物最多能与含5 mol NaOH的溶液反应
D.既能使酸性KMnO4 溶液褪色,又能与FeCl3溶液发生显色反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com