
【题目】下列有关如图有机物说法正确的是
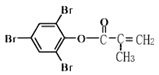
A.有机物中所有原子均在同一平面内
B.可发生的反应类型有取代、加成、还原、水解、氧化
C.1 mol 该化合物最多能与含5 mol NaOH的溶液反应
D.既能使酸性KMnO4 溶液褪色,又能与FeCl3溶液发生显色反应
科目:高中化学 来源: 题型:
【题目】实验室制备纯碱的主要步骤如流程所示:

四种盐在不同温度下的溶解度(g/100gH2O)表
温度 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
提示:温度高于35℃时NH4HCO3会分解,请回答:
(1)下列操作或描述正确的是________。
A.温度控制在30-35℃是因为温度太高NH4HCO3会分解,温度太低反应速率太慢
B.保温30min的目的是使反应充分进行
C.过滤后的滤液只有NH4Cl和NH4HCO3溶质
D.洗去晶体表面的杂质可以选用蒸馏水
(2)反应温度控制在30~35℃,为控制此温度范围,采取的加热方法为______________。
(3)常温时,过滤后主要得到NaHCO3晶体的原因是______________。
(4)灼烧NaHCO3晶体的装置为________。
A.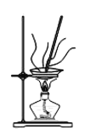 B.
B.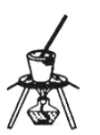 C.
C.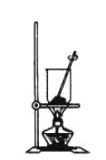
(5)洗涤NaHCO3晶体的操作______________。
(6)测定纯碱产品中NaHCO3含量的方法:准确称取纯碱样品Wg放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用物质的量浓度为c(mol·L-1)的HCl溶液滴定至溶液由红色到无色(指示CO32-+H+=HCO3-反应的终点)所用HCl溶液体积为V1mL。再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液体积为V2mL,写出纯碱样品中NaHCO3质量分数的计算式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CuO高温灼烧生成Cu2O,Cu2O与稀H2SO4反应的离子方程式为:Cu2O+2H+═Cu+Cu2++H2O。现将经高温灼烧后的CuO样品投入足量稀硫酸中得到混合溶液,有关说法正确的是( )
A.反应中Cu2O只作氧化剂
B.若有28.8g Cu2O参加反应,则转移电子数为0.2NA
C.Cu2O的稳定性比CuO弱
D.如果溶液中出现蓝色,说明CuO已分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有A、B、C、D四种无色溶液,它们分别是溶CH3COONa液、NH4Cl溶液,盐酸和NaNO3溶液中的一种。已知A、B的水溶液中水的电离程度相同,A、C溶液的pH值相同。
则:(1)①B是___溶液,C是___。
②常温下若B溶液中c(OH-)与C溶液中的c(H+)相同,B溶液的pH用pHb表示,C溶液的pH用pHc表示,则pHb+pHc=___![]() 填某个数
填某个数![]() 。
。
(2)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有以下几种:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
则:(Ⅰ)上述关系一定不正确的是___![]() 填序号
填序号![]() 。
。
(Ⅱ)若溶液中只有一种溶质,则该溶液中离子浓度的大小关系为___(填序号)。
(Ⅲ)若四种离子浓度关系有c(NH4+)=c(Cl-),则该溶液显___(填“酸性”、“碱性”或“中性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.![]() H、
H、![]() H、H+和H2是氢元素的四种不同粒子
H、H+和H2是氢元素的四种不同粒子
B.![]() Ca和
Ca和![]() Ca是两种不同的元素
Ca是两种不同的元素
C.![]() H和
H和![]() H是不同的核素
H是不同的核素
D.![]() C、
C、![]() C、
C、![]() C互为同位素,物理性质不同,但化学性质几乎完全相同
C互为同位素,物理性质不同,但化学性质几乎完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是重要的化工原料,经一系列反应可得到HNO3、CO(NH2)2、HCN等产品。
(1)以氨气为原料合成HNO3工艺如下,写出N2O4转化为HNO3的反应方程式_____。
![]()
(2)以NH3和CO2为原料生产尿素的反应如下:
反应Ⅰ:2NH3(l) + CO2(g) ![]() NH2COONH4(l) Δ H1 = a kJ·mol-1
NH2COONH4(l) Δ H1 = a kJ·mol-1
反应Ⅱ:NH2COONH4(l) ![]() NH2CONH2(l) + H2O(l) Δ H2 = b kJ·mol-1
NH2CONH2(l) + H2O(l) Δ H2 = b kJ·mol-1
① 已知NH3(l) ![]() NH3(g) Δ H3 = c kJ·mol-1 反应2NH3(g) + CO2(g)
NH3(g) Δ H3 = c kJ·mol-1 反应2NH3(g) + CO2(g) ![]() NH2CONH2(l) + H2O(l) Δ H4=_____kJ·mol-1(用含a、b、c的式子表示),该反应能自发进行的主要原因是_____。
NH2CONH2(l) + H2O(l) Δ H4=_____kJ·mol-1(用含a、b、c的式子表示),该反应能自发进行的主要原因是_____。
② 一定条件下,往恒容密闭容器中投入4 mol NH3和 1 mol CO2,测得各组分物质的量随时间变化如图1。下列说法正确的是_____。
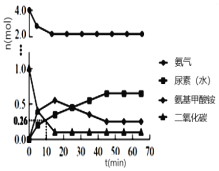
A.选择合适的碳氮比有利于提高产率
B.反应Ⅰ的活化能比反应Ⅱ小
C.过量氨气可以与反应生成的水结合,有利于尿素合成
D.气体物质的量不再变化时,反应达到平衡状态
(3)工业上利用氨气生产氢氰酸的反应为CH4(g) + NH3(g) ![]() HCN(g) + 3H2(g) Δ H>0
HCN(g) + 3H2(g) Δ H>0
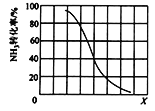
① 其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。X代表的是_____(填“温度”或“压强”)。

② 其它条件一定时,向2 L密闭容器中加入n mol CH4和2 mol NH3,平衡时NH3体积分数随n变化的关系如图所示。平衡常数K=_____(请写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在体积固定的密闭容器中发生可逆反应3X(g)![]() 2Y(g)+Z(g),下列能说明达到化学平衡状态的是
2Y(g)+Z(g),下列能说明达到化学平衡状态的是
A.压强不再发生变化B.ΔH的数值不再变化
C.反应物和生成物的浓度不再改变D.Y的生成速率是Z的生成速率的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里也可以利用以下反应制取少量氯气:2KMnO4+16HCl(浓)![]() 2KCl+2MnCl2+8H2O+5Cl2↑,关于该反应的说法正确的是( )
2KCl+2MnCl2+8H2O+5Cl2↑,关于该反应的说法正确的是( )
A.KMnO4中的锰元素被氧化
B.Cl2既是氧化产物,又是还原产物
C.HCl在反应中只做还原剂
D.每生成1molCl2转移电子的物质的量为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某温度下,将足量的BaSO4固体溶于一定量水中达到溶解平衡后,假定溶液体积不变的情况下,加入Na2CO3使c(CO32-)增大过程中,溶液中c(Ba2+)和c(SO42-)的变化曲线。根据图中的数据分析,下列说法正确的是:
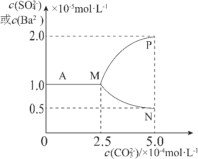
A.该温度下BaSO4的Ksp=2.5×10-9mol2·L-2
B.图中表示c(Ba2+)的曲线是MP
C.反应BaSO4(s)+CO32-(aq)![]() BaCO3(s)+SO42-(aq)的平衡常数K=0.04
BaCO3(s)+SO42-(aq)的平衡常数K=0.04
D.如用1LNa2CO3溶液将0.1molBaSO4固体完全转化为BaCO3,则原Na2CO3溶液浓度至少为2.5mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com