
【题目】现有下列几种物质:①盐酸;②Na2O;③Na2O2;④Al(OH)3;⑤Na2CO3;⑥H2O;⑦CO2;⑧乙醇;⑨Cu;⑩NaOH溶液。
(1)其中属于电解质的有___________(填写序号,下同),属于碱性氧化物的有_______。
(2)④与⑩反应的离子方程式为______________________________________。
(3)Na2O2因能发生下列反应被用作供氧剂:2Na2O2+2CO2=2Na2CO3+O2,该反应中,氧化剂与还原剂的物质的量之比为:______。
(4)如用超氧化钾(KO2)作供氧剂,写出它和CO2反应的化学方程式,并标出电子转移的方向和数目______________________________________________________。
【答案】②③④⑤⑥ ② Al(OH)3 + OH- = AlO2-+2H2O 1:1 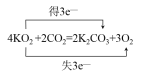 或
或![]()
【解析】
(1)①盐酸为混合物,不属于电解质;
②Na2O为离子化合物,属于电解质、碱性氧化物;
③Na2O2为离子化合物,属于电解质,过氧化物;
④Al(OH)3为离子化合物,属于电解质;
⑤Na2CO3为离子化合物,属于电解质;
⑥H2O属于电解质、氧化物;
⑦CO2不属于电解质,为氧化物;
⑧乙醇属于非电解质;
⑨Cu为单质,不属于电解质;
⑩NaOH溶液为混合物,不属于电解质;
(2)NaOH与氢氧化铝反应生成偏铝酸钠和水;
(3)过氧化钠中部分氧原子化合价升高为0价,部分降低为-2价,则过氧化钠既是氧化剂,又是还原剂,且物质的量之比为1:1;
(4)超氧化钾(KO2)中O2-平均价态为-0.5价,部分氧原子化合价升高为0价,部分降低为-2价,则升高的氧原子数目为降低氧原子数目的3倍。
(1)①盐酸为混合物,不属于电解质;
②Na2O为离子化合物,属于电解质、碱性氧化物;
③Na2O2为离子化合物,属于电解质,过氧化物;
④Al(OH)3为离子化合物,属于电解质;
⑤Na2CO3为离子化合物,属于电解质;
⑥H2O属于电解质、氧化物;
⑦CO2不属于电解质,为氧化物;
⑧乙醇属于非电解质;
⑨Cu为单质,不属于电解质;
⑩NaOH溶液为混合物,不属于电解质;
综上所述,属于电解质的为②③④⑤⑥;碱性氧化物的为②;
(2)NaOH与氢氧化铝反应生成偏铝酸钠和水,离子方程式为Al(OH)3 + OH- = AlO2-+2H2O;
(3)过氧化钠中部分氧原子化合价升高为0价,部分降低为-2价,则过氧化钠既是氧化剂,又是还原剂,且物质的量之比为1:1;
(4)超氧化钾(KO2)中O2-平均价态为-0.5价,部分氧原子化合价升高为0价,部分降低为-2价,则升高的氧原子数目为降低氧原子数目的3倍,则单线桥法为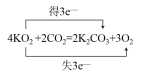 或
或![]() 。
。


科目:高中化学 来源: 题型:
【题目】与50 mL 0.1 mol·L-1的Na2CO3溶液中Na+的物质的量相同的溶液是( )
A.50 mL 0.2 mol·L-1的NaCl溶液B.100 mL 0.2 mol·L-1的NaCl溶液
C.25 mL 0.1 mol·L-1的Na2SO4溶液D.50 mL 0.1 mol·L-1的NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是( )
2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是( )
A. v(A)=0.15 mol·L-1·min-1B. v(B)=0.01 mol·L-1·s-1
C. v(C)=0.40 mol·L-1·min-1D. v(D)=0.45 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银铜合金广泛应用于航空工业。从银铜合金的切割废料中回收银和制备CuAlO2的流程
如下。
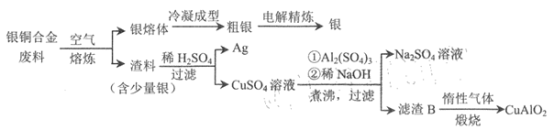
已知:Al(OH) 3和Cu(OH) 2开始分解的温度分别为450℃和 80℃。 下列说法错误的是
A.电解精炼时,粗银做阳极,纯银做阴极
B.为提高原料利用率,流程中应加过量的稀NaOH
C.滤渣B煅烧时发生的反应为 4CuO+4Al(OH)3![]() 4CuA1O2+ O2↑+6H2O
4CuA1O2+ O2↑+6H2O
D.若用 1.0 kg 银铜合金(铜的质量分数为64%) 最多可生成 10.0mol CuA1O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中药葛根是常用祛风解表药物,它的有效成分为葛根大豆甙元 F, 已用于治疗高血压引起的头疼、头晕、突发性耳聋等症。以下是以 A 为起始原料合成F 的一种方法:

回答下列问题:
(1) A 的化学名称为________________,B分子式为________________。
(2) C 中官能团的名称为________ , C→D的反应类型为 ______________。
(3)l molE 最多可与_____________________molH2 发生加成反应。
(4) F 与NaOH 溶液反应的化学方程式为 ________________。
(5)B 有多种同分异构体,同时满足下列条件的共有________种。
①属于芳香族化合物 ②可与NaHCO3溶液反应放出 CO2气体.其中,核磁共振氢谱有4 组峰,且峰面积之比为1:2:6:1的结构简式为 _________________(写出一种即可).
(6)已知:![]() 写出以A为原料制备化合物
写出以A为原料制备化合物![]() 合成路线____________________________ 。(无机试剂任选)
合成路线____________________________ 。(无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲![]() 乙
乙![]() 丙。下列有关物质的推断不正确的是( )
丙。下列有关物质的推断不正确的是( )
A.若甲为NaOH溶液,则丁可能是CO2B.若乙为Al(OH)3,则丁可能是NaOH
C.若甲为Fe,则丁可能是Cl2D.若丁是O2,则甲可能为C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2分别通入下列4种溶液中,有关说法正确的是( )
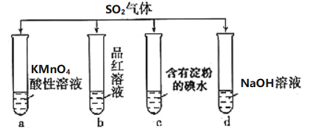
A.试管a中实验可以证明SO2具有漂白性
B.试管b中溶液褪色,说明SO2具有强氧化性
C.试管c中蓝色退去,说明还原性:SO2>I-
D.试管d中无明显现象,说明SO2不是酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
已知:①CuCl可以由CuCl2用适当的还原剂如SO2,SnCl2等还原制得:2Cu2++2Cl-+SO2+2H2O![]() 2CuCl↓+4H++SO42-,2CuCl2+SnCl2=2CuCl↓+SnCl4,②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子:
2CuCl↓+4H++SO42-,2CuCl2+SnCl2=2CuCl↓+SnCl4,②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子:  。
。
请回答下列问题:
(1)基态Cu原子的核外电子排布式为_____;H、N、O三种元素的电负性由大到小的顺序是____。
(2)SO2分子的空间构型为________;与SnCl4互为等电子体的一种离子的化学式为________。
(3)乙二胺分子中氮原子轨道的杂化类型为________。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是__________。
(4)②中所形成的配离子中含有的化学键类型有______(填字母)。
A.配位键 B.极性键 C.离子键 D.非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氨的叙述中不正确的是( )
A. 氨分子中氮元素的化合价只能升高,氨具有还原性
B. 氨的催化氧化反应的化学方程式是4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
C. 氨的催化氧化反应中若氧气过量则有红棕色气体生成
D. 氨的催化氧化属于人工氮的固定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com