
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
分析 A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E,A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的,则A是N元素;
D原子得到一个电子后其3p轨道将全充满,B+离子比D原子形成的离子少一个电子层,则B是Na元素、D是Cl元素,C与B可形成BC型的离子化合物,则C为F元素,E的原子序数为29,则E是Cu元素;
(1)元素A简单氢化物是NH3,A原子原子价层电子对个数是4,根据价层电子对互斥理论判断原子杂化类型;同周期随原子序数递增电负性增大,同主族自上而下电负性减小;含有氢键的物质溶解性大;
(2)比E少5个质子的原子是Cr元素,其原子核外有24个电子,根据构造原理书写基态电子排布式;
Fe晶体中其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比=(1+8×$\frac{1}{8}$):(8×$\frac{1}{8}$+6×$\frac{1}{2}$);
(3)晶格能与电荷成正比、与离子半径成反比,晶格能越大熔沸点越高;
(4)根据CO2+4H2→CH4+2H2O知,若有1mol CH4生成,则有6mol σ键和2mol π键断裂;
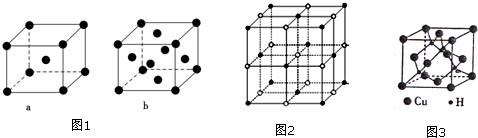
(5)该晶胞中Cu+个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,H-的个数=4,Cu+与H-的核间距为晶胞体长的$\frac{1}{4}$,晶胞棱长=$\root{3}{\frac{\frac{M}{{N}_{A}}×4}{ρ}}$cm3,其体长=$\sqrt{3}$×$\root{3}{\frac{\frac{M}{{N}_{A}}×4}{ρ}}$cm.
解答 解:A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E,A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的,则A是N元素;
D原子得到一个电子后其3p轨道将全充满,B+离子比D原子形成的离子少一个电子层,则B是Na元素、D是Cl元素,C与B可形成BC型的离子化合物,则C为F元素,E的原子序数为29,则E是Cu元素;
(1)元素A简单氢化物是NH3,N原子价层电子对数=3+$\frac{1}{2}$(5-1×3)=4,故NH3中N采取sp3杂化;
同周期随原子序数递增电负性增大,同主族自上而下电负性减小,故电负性Na<Cl<F;HF与水分子之间能形成氢键,而易溶于水;
故答案为:sp3;Na<Cl<F;HF与水分子之间能形成氢键;
(2)比E少5个质子的原子是Cr元素,其原子核外有24个电子,根据构造原理书写基态电子排布式为1s22s22p63s23p63d54s1或〔Ar〕3d54s1;
Fe晶体中其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比=(1+8×$\frac{1}{8}$):(8×$\frac{1}{8}$+6×$\frac{1}{2}$)
故答案为:1s22s22p63s23p63d54s1或〔Ar〕3d54s1;2:1;
(3)晶格能越大熔点越高,晶格能与电荷成正比、与离子半径成反比,
KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似,TiN中离子都带3个单位电荷,MgO、CaO中离子都带2个单位电荷,KCl中离子都带1个单位电荷,离子半径Cl-<O2-<N3-,Mg2+<Ca2+<K+,高价化合物的晶格能远大于低价离子化合物的晶格,晶格能TiN>MgO>CaO>KCl,故熔点TiN>MgO>CaO>KCl,
故答案为:TiN>MgO>CaO>KCl;
(4)根据CO2+4H2→CH4+2H2O知,若有1mol CH4生成,则有6mol σ键和2mol π键断裂,
故答案为:6;2;
(5)该晶胞中Cu+个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,H-的个数=4,晶胞棱长=$\root{3}{\frac{\frac{M}{{N}_{A}}×4}{ρ}}$cm3,其体长=$\sqrt{3}$×$\root{3}{\frac{\frac{M}{{N}_{A}}×4}{ρ}}$cm,Cu+与H-的核间距为晶胞体长的$\frac{1}{4}$=$\frac{\sqrt{3}}{4}×$×$\root{3}{\frac{\frac{M}{{N}_{A}}×4}{ρ}}$cm=$\frac{\sqrt{3}}{4}×$$\root{3}{\frac{65×4}{d{N}_{A}}}$cm,
故答案为:$\frac{\sqrt{3}}{4}×$$\root{3}{\frac{65×4}{d{N}_{A}}}$.
点评 本题考查物质结构和性质,侧重考查分析推断及计算能力,涉及晶胞计算、晶格能、原子核外电子排布、元素周期律等知识点,这些都是高频考点,难点是(5)题晶胞计算,题目难度中等.


科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
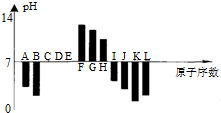
| A. | 元素B对应的氢化物比J对应的氢化物熔沸点更高,原因是B的氢化物中的键能比J中的大. | |
| B. | 根据图形分析可知,K,L两种元素最高价氧化物对应的水化物的酸性,前者较强. | |
| C. | 晶体IC2熔化时克服的化学键和晶体KC2与水反应时克服的化学键,类型相同. | |
| D. | 元素K、H、G分别形成的简单离子的半径逐渐减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
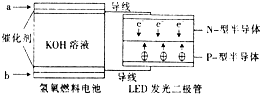 LED系列产品是被看好的一类节能新产品.如图是一种氢氧燃料电池驱动LED 发光的装置.下列有关叙述正确的是( )
LED系列产品是被看好的一类节能新产品.如图是一种氢氧燃料电池驱动LED 发光的装置.下列有关叙述正确的是( )| A. | a处通入氢气,发生还原反应 | |
| B. | b处为电池正极,发生了还原反应 | |
| C. | 该装置中只涉及两种形式的能量转化 | |
| D. | P-型半导体连接的是电池负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清透明的溶液中:MnO4-、SO42-、K+、Fe3+ | |
| B. | 0.1 mol•L-1FeCl3溶液中:Mg2+、NH4+、SCN-、SO42- | |
| C. | 滴入甲基橙显黄色的溶液中:Na+、ClO-、I-、SO42- | |
| D. | 水电离产生的c(H+)=10-12 mol•L-1的溶液中:K+、Na+、NO3-、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该混盐水溶液呈碱性 | |
| B. | 该混盐与H2SO4反应有气体生成 | |
| C. | 该混盐溶液加入BaCl2可以生成白色沉淀 | |
| D. | 该混盐在酸性条件下可生成S,每产生32g S转移2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com