
下列说法错误的是 ( )
A.钠和铁一样,都能在氯气中燃烧生成金属氯化物
B.液氯是氯气的水溶液,它能使干燥的有色布条褪色
C.氯气跟变价金属反应生成高价金属氯化物
D.氯水具有杀菌、漂白作用是因为氯水中含有强氧化性的次氯酸
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温下,0.05 mol·L-1 Fe2(SO4)3溶液中含Fe3+数目为0.1NA
B.标准状况下,22.4 L甲苯中含C-H数目为8 NA
C.常温下,9.2 g NO2和N2O4的混合气体中含有的氮原子数目为0.2 NA
D.1 mol氯气和足量NaOH溶液反应转移的电子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应中,水可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Cl2+SO2+2H2O===H2SO4+2HCl相比较,水的作用不相同的是
A.3NO2+H2O===2HNO3+NO B.2Na2O2+2H2O===4NaOH+O2↑
C.4Fe(OH)2+2H2O+O2===4Fe(OH)3 D.3Fe+4H2O(g)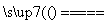 Fe3O4+4H2
Fe3O4+4H2
查看答案和解析>>
科目:高中化学 来源: 题型:
向22.4g的Fe2O3、Cu的混合物中加入0.5mol/L的硫酸溶液600mL时,固体恰好完全溶解,所得溶液中不含Fe3+,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为
A.6.4g B.4.8g C.2.4g D.1.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌。某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:

回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为_ _
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的_______操作.
(3)浸出液“净化”过程中加入的主要物质为________,其作用是__________________。
(4)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气体是____
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生的主要反应的离子方程式为____________________。
(6)我国古代曾采用“火法”工艺冶炼锌。明代宋应星著的《天工开物》中有关于 “升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。”该炼锌工艺过程主要反应的化学方程式为____ 。(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是 ( )
A.实验室用大理石和稀盐酸制取CO2:2H+ + CO32- = CO2↑+ H2O
B.氢氧化钡溶液与盐酸反应:OH-+H+ = H2O
C.硫酸铜溶液与氢氧化钡溶液混合:Cu2+ + 2 OH-= Cu(OH)2↓
D.钠投入水中:Na +H2O = Na+ + OH- + H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,在溶液中可以发生反应:X + 2Y3+ == X2+ + 2Y2+ ,则下列解释正确的是 ( )
①X被氧化 ②X是氧化剂 ③X具有还原性 ④Y2+是氧化产物 ⑤Y2+具有还原性 ⑥Y3+ 的氧化性比X2+强
A、②⑤ B、②④⑥ C、①③④ D、①③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关热化学方程式的叙述正确的是
| A | 已知2H2O(g)= 2H2(g)+O2(g) △H=+483.6 kJ/mol,则氢气的燃烧热为 △H=﹣241.8kJ/mol | |
| B. | 已知C(石墨,s)= C(金刚石,s) △H>0,则金刚石不如石墨稳定 | |
|
| C. | 已知中和热为△H =﹣57.3kJ/mol,则稀醋酸和稀NaOH溶液反应的热化学方程式为: NaOH(aq)+ CH3COOH(aq)= CH3COONa(aq)+ H2O(l)△H=﹣57.3kJ/mol |
|
| D. | 已知2C(s)+ 2O2(g) = 2CO2 (g) △H1; 2C(s)+ O2 (g) = 2CO(g) △H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
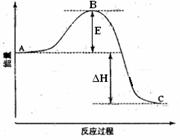
2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ·mol-1。请回答下列问题:
(1)图中A表示 ,E的大小对该反应的反应热 (填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点 (填“升高”还是“降低”),△H (填“变大”、“变小”或“不变”),理由是
(2)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H(要求计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com