
氧化还原反应中,水可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Cl2+SO2+2H2O===H2SO4+2HCl相比较,水的作用不相同的是
A.3NO2+H2O===2HNO3+NO B.2Na2O2+2H2O===4NaOH+O2↑
C.4Fe(OH)2+2H2O+O2===4Fe(OH)3 D.3Fe+4H2O(g)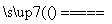 Fe3O4+4H2
Fe3O4+4H2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
已知有机物之间能发下如下反应:
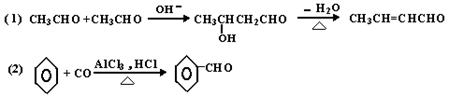
下列有机化合物A~H有如下图所示的转化关系:
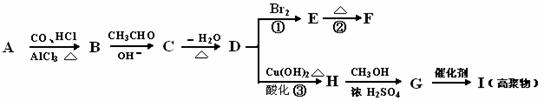
其中,化合物D的分子式为C10H10O,其苯环上的一氯代物只有两种;F的分子式为C10H8O,且所有碳原子在同一平面上。请回答下列问题:
(1)写出下列物质的结构简式:A I
(2)反应①的反应类型为 反应②的条件为 。化合物F中氢原子的种类有 种。
(3)写出下列反应的化学方程式:B→C 。
(4)化合物D有多种同分异构体,满足下列条件的有6种(一个碳原子上不可能两个双键):①属于酚类;②结构中除苯环外无其他环;③苯环上只有两种互为对位的取代基。其中的三种结构简式如下:
请写出其它三种结构简式
查看答案和解析>>
科目:高中化学 来源: 题型:
二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能。工业制备二甲醚的生产流程如下:
催化反应室中(压力2.0~10.0MPa,温度300℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g) △H 1= - 90.7 kJ·mol-1
CH3OH(g) △H 1= - 90.7 kJ·mol-1
②2CH3OH(g)  CH3OCH3(g)+H2O(g) △H2 = - 23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2 = - 23.5 kJ·mol-1
③CO(g)+H2O(g)  CO2(g)+H2(g) △H3 = - 41.2 kJ·mol-1
CO2(g)+H2(g) △H3 = - 41.2 kJ·mol-1
(1)催化反应室中的总反应:3CO(g)+3H2(g)  CH3OCH3(g)+CO2(g)。
CH3OCH3(g)+CO2(g)。
该反应的反应热△H =_________。催化反应室中采用300℃的反应温度,理由是 。
(2)已知:反应①在300℃时的化学平衡常数为0.27。该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将 (填“正向进行”、“逆向进行”或“处于平衡状态”)。
(3)上述流程中二甲醚精制的实验操作名称为 。
(4)右图为绿色电“二甲醚燃料电池”的工作原理示意图。
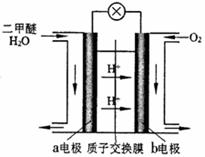
该电池工作时,H+向 极移动(填“正”或“负”);a电极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列所作出的结论中一定正确的是( )
A.无色试液使红色石蕊试纸变蓝,结论:该试液一定是碱溶液
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO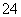
C.无色试液焰色反应呈黄色,结论:试液中一定含有Na+
D.无色试液加入碳酸钠溶液产生白色沉淀,结论:试液中含氢氧化钙
查看答案和解析>>
科目:高中化学 来源: 题型:
I.二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
完成下列填空,
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式 。
如不对该反应还原产物的比例作限制,该反应 出现多组配平系数(填“可能”或“不可能”)并说明理由 。
(2)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI十HNO3 Se+I2+KNO3十H2O
Se+I2+KNO3十H2O
②I2+2Na2S2O3 Na2S4O6+2NaI
Na2S4O6+2NaI
实验中,准确称量SeO2样品0.160 0 g,消耗了0.200 0 mol L-1的Na2S2O3溶液25.00mL,所测定的样品中SeO2的质量分数为
L-1的Na2S2O3溶液25.00mL,所测定的样品中SeO2的质量分数为
II .高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝、助凝、杀菌、除臭为一体的新型高效多功能绿色水处理剂,具有良好的应用前景。其生产工艺如下:
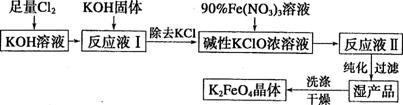
已知:①2KOH+Cl2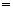 KCl+KClO+H2O(条件:温度较低)
KCl+KClO+H2O(条件:温度较低)
②6KOH+3C12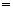 5KCl+KClO3+3H2O(条件:温度较高)
5KCl+KClO3+3H2O(条件:温度较高)
回答下列问题:
(1)该生产工艺应在 (填“温度较高’’或“温度较低”)的情况下进行。
(2)写出Fe(NO3)3在强碱性条件下与KClO反应制K2FeO4的离子方程式 。
(3)在“反应液I”中加KOH固体的目的是 (填序号)。
A.与“反应液I”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物 D.使副产物KClO3化为KClO
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D之间的转化关系A + B → C + D,下列说法不正确的是
A.若A为Fe,D为氢气,则B可能是酸,也可能是水
B.若A、D为化合物,B为水,则C可能是气体单质,也可能是化合物
C.若A、B、C、D均为化合物,该反应一定属于复分解反应
D.若A、B、C、D均为10电子微粒,且C是可使湿润的红色石蕊试纸变蓝的气体,则D常温下一定呈液态
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁4种物质均为含有两种元素的化合物,其分子均含有18个电子,下列说法正确的是
A.若气体甲的水溶液在常温下的pH<7,则甲一定是HCl
B.若气体乙的摩尔质量与O2相同,则乙一定是N2H4
C.若3.0g丙的物质的量为0.1mol,则丙一定是甲烷的同系物
D.若丁为四原子分子,则丁一定能使品红溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是 ( )
A.钠和铁一样,都能在氯气中燃烧生成金属氯化物
B.液氯是氯气的水溶液,它能使干燥的有色布条褪色
C.氯气跟变价金属反应生成高价金属氯化物
D.氯水具有杀菌、漂白作用是因为氯水中含有强氧化性的次氯酸
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下图中物质M是由同一短周期的两种元素组成的离子化合物,焰色反应为黄色,阴离子元素最高正价与它的负价代数和为6。X具有漂白性,Y为碱性气体,W是对空气无污染的气体。试回答下列问题:
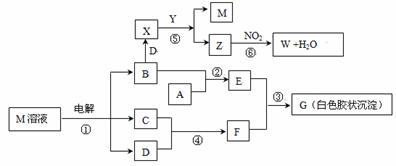
(1)写出电解M溶液①的化学方程式 。
(2)已知工业上制备Y气体,每生成1molY时放出的热量为akJ(该热量已合算成25℃,101KP),请写该反应的热化学方程式 。
(3)若A是一种常见金属,写出反应②的离子方程式 。
(4)若A是某元素的一种常见酸性氧化物,则A的化学式为 ;其用途为 。(写出一种即可)
(5)写出反应⑤的化学方程式 。
(6)标准状况下,反应⑥中生成11.2L W时转移的电子数 。(用NA表示阿伏加德罗常数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com